- 股票掌故
- 香港股票資訊
- 神州股票資訊
- 台股資訊
- 博客好文
- 文庫舊文
- 香港股票資訊
- 第一財經
- 微信公眾號
- Webb哥點將錄
- 港股專區
- 股海挪亞方舟
- 動漫遊戲音樂
- 好歌
- 動漫綜合
- RealBlog
- 測試
- 強國
- 潮流潮物 [Fashion board]
- 龍鳳大茶樓
- 文章保管庫
- 財經人物
- 智慧
- 世界之大,無奇不有
- 創業
- 股壇維基研發區
- 英文
- 財經書籍
- 期權期指輪天地
- 郊遊遠足
- 站務
- 飲食
- 國際經濟
- 上市公司新聞
- 美股專區
- 書藉及文章分享區
- 娛樂廣場
- 波馬風雲
- 政治民生區
- 財經專業機構
- 識飲色食
- 即市討論區
- 股票專業討論區
- 全球政治經濟社會區
- 建築
- I.T.
- 馬後砲膠區之圖表
- 打工仔
- 蘋果專欄
- 雨傘革命
- Louis 先生投資時事分享區
- 地產
Random Tags
國家食藥監管總局:將整治中藥材市場亂象
http://www.infzm.com/content/93026據國家食品藥品監督管理總局官方網站消息,7月30日,國家食品藥品監督管理總局副局長吳湞主持召開中藥材專業市場整治約談會,約談亳州、安國等全國17個集中的中藥材專業市場所在地政府負責人。
消息稱,國家食藥監管總局通過對部分中藥材專業市場摸底調查,發現中藥材專業市場及其周邊存在假冒偽劣、摻雜使假、違規經營、非法加工等現象,個別地方還比較嚴重。
據《第一財經日報》報導,吳湞在會上說:「今天請來17個中藥材(市場所在)的地市級政府,目的是給大家擺問題,堅決進行整治,今天我們這個會是約談會,實際也是中藥材市場整頓的開始。」
會議決定將整治中藥材專業市場,清理市場周邊環境,並將配備專門機構和專門人員負責中藥材專業市場管理。
而據《上海證券報》報導,國家食藥監管總局內部人士透露,近日已安排5個工作組,奔赴國內幾大重點中藥材市場進行調查。
早在7月12日,國家食藥監總局便宣佈展開「兩打兩建」專項行動,打擊中藥違法生產行為、整治中藥材專業市場便是重點之一。
據前述《第一財經日報》報導,食藥監總局工作組暗訪演示稿顯示,假冒偽劣、摻雜使假、違規經營、非法加工已在國內多個中藥材市場成風,並構成了一個隱秘的「地下王國」。
食藥監總局工作組在安徽亳州、河北安國、成都荷花池、廣東清平、廣西玉林五大中藥材市場暗訪發現,僅僅在安徽亳州,中藥材市場就存在著增重、以次充好等九大問題。在河北安國中藥材交易市場,工作組走訪附近12個村落發現,其中一些村落存在露天保存藥材的情形,多個無證家庭飲片加工作坊,均是設備簡陋,衛生堪憂,藥材質量堪憂。
事實上,中藥材專業市場存在的問題已不鮮見。
據《南方週末》2012年9月20日報導,2012年9月8日,國家藥監局通報稱,安徽省查獲一批染色增重、制假售假的中藥飲片生產企業,其中8家停產整頓、12家立案調查。上述企業涉嫌用化工色素金胺O進行染色,用鋁鹽和鎂鹽加重,在藥材中摻假。
《南方週末》2011年3月17日報導稱,在全國17個專業批發市場,摻假、再加工的情況十分嚴重。以安徽亳州市場為例,由於獨活、歐當歸的摻入,岷縣當歸經過千里跋涉,在安徽亳州切片損耗後,竟比原產地的價格還低。而甘草由於品種多元,也遭魚目混珠,直接影響到品質。
國家食藥監總局此次正式展開專項整治,效果仍需拭目以待,一些省份對此已下達部署工作的文件。
據亳州市政府人士介紹,自7月17日,食藥監總局召開「兩打兩建」會議,亳州便連夜召開會議,並成立了專門的小組。亳州共檢查了5000家攤點和門店,設立了100萬元的舉報獎勵,一次性獎勵可以達20萬元。
據國家食藥監局官方網站消息,黑龍江省、浙江省、山西省等地區已在7月份分別宣佈部署「兩打兩建」行動,
據瞭解,此次被約談的17個中藥材專業市場是1996年經國家中醫藥管理局、衛生部、國家工商行政管理局審核批准設立的,由地方政府直接領導的市場管理委員會進行管理。
據前述《上海證券報》報導,吳湞在約談會上表示,二十多年裡沒有新增、新批中藥材市場,今後也不會再批了。
17個中藥材專業市場所在地是:
河北保定市,黑龍江哈爾濱市,安徽亳州市,江西宜春市,山東菏澤市,河南許昌市,湖北黃岡市,湖南長沙市、邵陽市,廣東廣州市、揭陽市,廣西玉林市,重慶渝中區,四川成都市,云南昆明市,陝西西安市,甘肅蘭州市。
(轉載)中藥材遭遇污染困局 「道地藥材」不再地道 金楓海客
http://blog.sina.com.cn/s/blog_4b6f4b4a0102exuz.html$中國中藥(00570)$ 評論 歲寒知松柏
http://xueqiu.com/1272530506/28389344$中國中藥(00570)$ 出年報竟然沒有一個人評論,怪事。一大早我躺在床上用手機看它的年報,我原以為市場會認為不好,若大跌一把,那還可以考慮加倉。
其實它的年報是很不錯的,特別是毛利增長高達46%,只是銷售費用增加很多,這大概同盈天與同濟堂初期整合有一些關係。我之所以說它年報不錯,原因:
一是570去年借殼和收購同濟堂,2012年盈天和同濟堂的業績肯定有意做高,所以去年利潤同比有增長已經很好了。
二是同濟堂只算了11和12兩個月的收入和利潤,並未全年合併報表,年報也沒披露同濟堂全年的收入和利潤是多少。
570中國中藥是國藥集團借殼的子公司,國藥計劃把一致打造成西藥平台,而570打造成中藥平台。預計國藥的中藥未來可以做到1000億的規模,目前570才90億的市值,整合空間很大。
570目前擁有的中藥品種非常多,中西藥品種和規格的生產批文合計高達500多個, 有26個獨家產品被列入國家基本醫療保險用藥目錄,其中仙靈骨葆膠囊/片、玉屏風顆粒、鼻炎康片、頸舒顆粒、潤燥止癢膠囊、風濕骨痛膠囊和棗仁安神膠囊被列為國家基本藥物目錄。
570預計在經過2013年的整合後,今年業績會開始釋放。假設沒有新的資產注入,570它2014年賬面利潤我估計至少會翻倍到4億人民幣以上,相當於目前16倍的pe,這在快速成長的中藥股裡應該是很低的。
國藥的管理機制不錯,在資本市場裡口碑好,可以投一信任票。看來市場比我想像的聰明,分析師都會看財報,呵呵。
聲明:本人持有中國中藥。
附帶提一下,$羅欣藥業(08058)$ 今年以來漲幅高達5成,業績完全符合我的預期,大摩在年報前故意買夠5%舉牌,似乎他們比我還有信心。
8058去年我做年終總結時有向大家道歉,以前因為我對醫藥一竅不通過早買入處於轉型初期的它並誤導了大家,浪費了寶貴的時間,錯過了醫藥股大牛行情,但我想只要我學費交了後能有反思總結和進步,那也還是值得的,謝謝e朋友們的鼓勵!
一紙行政通知,破解26年密局 中藥守密:「哈姆雷特式」難題
http://www.infzm.com/content/100114企業認為,公佈中藥有毒成分是政府規避責任,將用藥風險轉嫁給了醫務人員和消費者;學界則認為,中藥品種保護不僅讓企業喪失進取心,「出海」受阻,更帶來諸多不良反應風險。
按照食藥總局的《通知》,備案期限已過。除同仁堂、上海雷允上、西安阿房宮藥業等中藥企業對南方週末記者表示已如期完成報備外,其餘企業,未給出明確答覆。
解「毒」風波
一個守了26年的秘密,終要大白於天下。
2014年4月,云南白藥修改了藥品說明書,正式宣佈配方中含有「草烏」,草烏中含有烏頭鹼等生物鹼,其塊根有大毒,但入藥能祛風除濕,溫經止痛。
云南白藥在修改後的新版說明書上標註:「本品含草烏(制),其餘成分略。」這也是云南白藥第一次在國內標註其含有毒性成分。
過去的26年,和云南白藥一樣,一些知名的中成藥始終以其獨特配方、工藝在中藥保護密室中難以觸碰,即便含毒性藥材,也從未在國內公開。
然而,一份通知正在改變這一切。
半年前,國家食品藥品監督管理總局(下稱「食藥總局」)出台了一項新規。這份名為《關於修訂含毒性中藥飲片中成藥品種說明書的通知》(下稱《通知》)規定,產品中含有28種毒性藥材的中藥飲片企業、中成藥品種,必須在說明書中寫明毒性成分並添加警示語。
南方週末記者在中國最大的醫學藥學專業網站丁香園查詢後發現,目前國內生產的含生川烏成分的藥品13個、含生草烏成分的藥品11個、含生半夏的藥品19個、含蟾酥的藥品25個、含雄黃的藥品51個(均在28種毒性藥材之內),涉及云南白藥、同仁堂、上海和黃、廣州白雲山、太極集團、漳州片仔癀、江西濟民可信、杭州天目山等多家知名藥企。
通知一出,企業惶然。按照《通知》,生產企業最晚在2013年12月31日前,提出修訂說明書的補充申請報備案,並在備案後6個月內對已出廠的說明書予以更換。
如今,備案期限已過。同仁堂、上海雷允上、阿房宮藥業等中藥企業均對南方週末記者表示已如期完成報備,但通知仍讓一些企業措手不及。
「這(通知)把用藥風險從藥監部門和企業轉嫁給了醫務人員和消費者,讓消費者在用藥時自己注意。」阿房宮藥業的技術部人員頗有微詞。
更有企業高管十分不滿。「與其這樣列出有毒成分給一群缺乏醫藥用藥常識的受眾,倒不如花精力在用藥指導和合理用藥上。列出有毒成分在規避責任上也許有些作用,但是從整體來看並無助於中醫藥的良性發展。」
一位不願具名的中藥企業高管認為企業應該做的是,總結積累不良反應,將不良反應明示在說明書上。對於傳統品種,有著長期臨床使用歷史的成熟藥品,更應注重對醫生和患者的教育,建立正確的用藥方法和對中藥的認識。「中藥不是可以有病沒病隨便吃的東西,它是藥!」
直至南方週末截稿前,針對備案及修改說明書,其餘企業,未給出明確答覆。
遵守一個規定,違反另一個?
「部門通知怎麼能大於法律?」國家中藥現代化工程技術研究中心主任曹暉對食藥總局出台的《通知》非常不解。
曹暉所指的衝突源於兩條為中成藥打造保密金鐘罩的法律法規。
26年前,也即1988年,全國人大通過《中華人民共和國保守國家秘密法》,該法明確了科學技術中的秘密事項和密級。云南白藥、片仔癀等傳統中藥,也在這時被列入保密科學技術之中。其中,云南白藥配方、工藝被列入國家絕密。
據南方週末記者瞭解,絕密級別保護分為兩種。一種是絕密級的中藥製劑包括云南白藥、雷允上六神丸、片仔癀、華佗再造丸、安宮牛黃丸、麝香保心丸等。而另一種是珍稀中藥材的人工製成品的配方工藝,如人工合成麝香牛黃等。
上述產品在中藥產品中被譽為國寶,可以長久保有自己的配方不公開,這也致使它們在同類藥品中的銷量一直居於全國前列。
時隔五年,1993年,國務院頒佈的《中藥品種保護條例》(以下簡稱《條例》)正式實施。根據《條例》,中藥一級保護品種年限分別為三十年、二十年、十年;二級保護品種為七年。中藥一級保護品種的處方組成、工藝製法不得公開。被批准保護的中藥品種,僅限於由獲得《中藥保護品種證書》的企業生產。
之後,云南白藥散劑和云南白藥膠囊都被列入國家中藥一級保護品種,保護起止時間為1995年8月17日至2015年8月17日。食藥總局《通知》出台時,云南白藥仍在保護期內。
「不能遵守一個規定,違反另一個法規啊。」曹暉不解。
不過,學者們認為,公佈毒性成分,並提出藥品安全風險提示,並不意味著從整體上將中藥的處方組成和工藝製法完全公開,因為中藥的成分劑量、生產工藝及其它非毒性成分等關鍵信息都仍處於保密狀況。
另外,這是法律條款中很常見的一般法和特殊法之間的關係。廣州市律師協會醫事律師程躍華認為,法律的首要意義在於保護人民群眾的生命與財產安全,而《通知》的目的在於保障消費者用藥安全,也是對原有的《中華人民供和國保守國家秘密法》和《中藥品種保護條例》的有益補充。
「這並不是衝突。一般法都會有留一個口子,讓相關部門規章進行解釋和微調。」國家行政學院副教授胡穎廉說。
保密太長、太多,等於保護落後?
在大多中醫學者看來,最初的保密保護,更像是不得已而為之。
「當時同一品種生產廠家太多,價格競爭很激烈,產品質量參差不齊,比如蛇膽川貝液就有一百九十幾家企業生產。」國家中藥保護品種審評委員、中國中醫科學院專家委員會委員周超凡還能想起上世紀九十年代我國中成藥產業低水平重複建設的混亂景象。
在他看來,一方面由於我國中藥領域專利保護意識較弱,認為成分公開會洩露其技術秘密,因而申請專利的積極性很低;另一方面,許多中藥處方多為古方、舊方傳承,不具備申請專利所需的「新穎性、創造性、實用性」特點,中藥申請專利困難重重。又因為中藥處方複雜,即使發生侵權,也難以通過現有技術進行鑑定。所以許多中藥生產企業都借助政府提供的難得機遇,積極申報保護品種。
《條例》實施21年來,成千上萬個中藥品種得到了「保護」。但這並不是促進產業發展的長久之計。
「保密的應該是關鍵工藝、製劑,不應該是成分。否則,保密時間太長、太多,就等於保護落後。」周超凡覺得中成藥保護工作已陷入瓶頸。
長期以來,保密品種中可能含有的毒性藥材,一直以一種模糊不清的方式隱約出現,這也致使中成藥不良反應糾紛時有發生。
2009年4月、6月,四川明炬律師事務所律師趙因曾購買了云南白藥內服,先後兩次出現不良反應。趙因查閱相關文獻後發現,云南白藥處方中含有草烏,但沒有在說明書中予以警示。
當年7月,趙因以云南白藥股份有限公司為被告提起了侵權訴訟,認為云南白藥股份侵犯了患者和醫務人員的知情權,要求云南白藥在藥品說明書中標明完整處方藥味。云南白藥公司不予認可,理由是云南白藥處方工藝為國家機密。趙因就此敗訴。
事實上,中藥的不良反應並不少見。根據中國藥學會2006年對國內1551例藥物不良反應病例分析,中藥不良反應所佔比僅次於抗生素類藥物而位居第二。
保密理由也讓中成藥說明書含糊其辭。安徽省池州市人民醫院藥劑科劉彩虹醫生在對90份中藥說明書調查分析後發現,中藥說明書普遍存在著缺少藥理、毒理、藥代動力學、不良反應、禁忌注意事項、孕婦及哺乳期婦女用藥、兒童用藥、老年患者用藥、藥物相互作用、藥物過量等重要項目的描述,對常見問題敘述不清晰,難理解。
在論文中,劉彩虹稱「這是少數藥品企業為了保密採取的一種極不負責任的做法」。
為推動公開,2006年,國家藥監局發佈了《關於印發非處方藥說明書規範細則的通知》規定,除中藥一級保護品種之外,藥品說明書中必須列出全部處方組成和輔料,處方所含成分及藥味排序應與藥品標準一致。之後的調整便是食藥總局最新的《通知》。
即便已是8年之後的新調整,涉事的部分企業仍認為「操之過急」。
「作為一個保護品種,中醫藥行業的知識產權保護實在不夠。用西醫的模式來看待中藥,不太利於中醫中藥的發展。」白雲山潘高壽藥業公司總工程師盧其福說。

我國關於中藥保密相關法律法規。 (曾子穎/圖)
「命根子」不公開,「留洋」障礙重重
不談保密制度是否需要修改,制度本身已成為阻礙中成藥國際化的重要原因。
中成藥「出海」,原本是一個多贏的局面。由於中西方藥品管理制度的差別,中藥國際化道路舉步維艱,至今沒有一種中成藥能在美國和歐盟成功註冊。其中,公佈藥品處方,即使是保密配方,恰恰是進入國際市場的第一步。
早在2010年,云南白藥在美國銷售的產品成分表中,就清楚羅列其配方。2013年2月,香港衛生總署檢出云南白藥含有烏頭鹼,並責令相關藥品下架。之後,云南白藥稱配合港署補充完善相關產品註冊程序後已恢復銷售,這也一度被指責為雙重標準。
西藥重視成份量化分析,這也是藥品質量控制的關鍵,而中藥是多味藥物的不同劑量配伍,很難量化。癥結也正在於此,長期以來,我國中藥研發過於注意在中藥處方組成上下功夫,忽視了對療效和質量也有重要影響的製作工藝、劑型等重要要素的革新,創新性和現代技術含量並不高,因而一旦中藥成分公佈就極容易被仿製。因此,很多中藥企業都有自己的獨家配方,並視之為「命根子」,不願公開配方。
事實上,對藥品和企業而言,《條例》也是雙刃劍。原因很簡單,某個產品申請了中藥品種保護以後,有些企業就不再提高產品的科技含量,從而影響了藥品的二次研發。加之「被保密的藥品」存在「洩密」的顧慮,企業很少與外部研究機構合作。
「國外的新藥專利保護,也就十年而已。」周超凡無法理解國內長時間的保密制度。
更大的擔憂在於,政府一直在中藥市場扮演著「守夜人」的角色,這種行政色彩濃厚的保護與市場經濟發展相悖而行。
「國家直接干涉某個行業的發展、規定生產企業個數本身就是不對的。藥品一旦進入保護目錄,就天然貼上了『質量穩定、療效確切』標籤,因而更容易獲得較高的市場佔有率,這導致其他產品無法正常進入競爭市場。」浙江工業大學藥品食品政策法規和產業發展研究所副所長董作軍說。
保密還是公開?
保密還是公開,仍是一個哈姆雷特式的難題。學者們擔心目前的監管難以滿足國內中藥企業的需求,而大眾更擔心自己買到含有不明成分的藥物。
「從產業角度來說,全部保密是最好的,從公共安全角度來說,消費者需要知情權和健康權。作為政府,消費者的訴求佔了上風,便會進行微調。」胡穎廉說。
原國家食品藥品監督管理局副局長任德權認為,標示毒性成分,已經是一個進步。云南白藥作為戰備物資,其處方組成是國家技術秘密。除毒性成分外,其他成分按國家保密要求不能公開。
如今,趙因與云南白藥的官司已經過去了近5年。雖然云南白藥此次修改說明書,是一次「遲到的糾錯」,但趙因卻不願再繼續追究下去了。
「不管是保密的還是不保密的配方,只要中藥成分含有毒性成分,都應該標註出來。這樣不僅對患者起到警示作用,在醫務人員用藥時,也能起到警示作用。既然現在云南白藥公司已經把草烏這一成分標註出來,我的目的也就達到了。」趙因說。
「保密制度是多年以前法制和市場不夠健全的產物,所有的藥品監管都應該以消費者用藥安全為重。」 全國合理用藥監測網專家孫忠實不以為然。
其實,除了國家科學技術秘密保護和中藥品種保護外,我國還有包括專利保護、商標保護等多種形式。但由於中藥品種保護申請門檻較低,不用公開技術特徵,保護時間甚至比專利更長,使得我國中藥領域熱衷中藥品種保護,忽視專利保護等其他保護形式。
周超凡堅持認為,全球化時代,不論中藥西藥,都得走專利的道路。而現在可以逐步減少對中藥品種保護的審批,向專利保護為主的保護形式過渡。
原國家中醫藥管理局副局長諸國本也同意上述觀點。「行政保護現在還是有現實意義的,但比較落後了,恐怕還要走專利保護的路子。」
在複雜的公共安全、產業利益和政治利益面前,「能不能想出一種辦法,既能增加配方的透明度,又讓企業不是完全通過掌握配方來獲取利潤的?比如擁有獨特的工藝和流程?」胡穎廉說。
中國中藥粉飾的業績已漂白 歲寒知松柏 歲寒知松柏
來源: http://blog.sina.com.cn/s/blog_627a300f0102v3pt.html經測算,$中國中藥(00570)$中報對比2011年無粉飾業績期,3年收入複合增長率18%,利潤複合增長率60%;對比12年收購粉飾期分別都增長26%;對比13年中分別增長21%和68%,經調整後應該也有40%左右的增速。分析如下:
毫無疑問,國藥的兩次收購,包括盈天和同濟堂,當初的利潤都是有水份的。比如盈天的收購條件是:如果2012年利潤超過1.9億港元,收購對價就由1.4港幣上升到1.7港幣。
於是乎盈天的利潤就從2011年的0.72億急升到2012年的2.07億,2012年上半年也才0.78億,收入同比只增長了2成,利潤卻增長了近2倍,其中下半年更是激增300%以上。而之前的兩年利潤增速分別不到2成和4成,所以2012年的利潤明顯是為了提高收購價格而沖的業績,利潤水份很大,到2013年中報收購完成後業績原形畢露,同比基本0增長,好在還沒有倒退。
2013年下半年收購同濟堂也是有水份的,我們看同濟堂收購前2010-2012年的業績就非常清楚,收入分別是5.8億、9.1億和12.7億港元,利潤分別是0.46億、0.45億、1.69億港元,其中2012年利潤增長300%非常高。而2013年前4個月收入為3.9億港幣,利潤為0.34億港幣,同比增長回落到30%,金額不到2012年的三分之一,而當時的收購代價為2012年利潤的19倍PE。
經查詢複星醫藥的財報,2013年中同濟堂收入為5.38億人民幣,利潤為0.495億人民幣,2012年全年為10.57億元和1.58億元,2012年中為4.44億元和0.255億元(此處有矛盾:570收購公告中2013年1-4月收入3.56億港元,利潤0.265億港元,折成人民幣分別為2.85億元和0.212億元,難道五六兩個月收入和前4個月相當但利潤僅和1個月差不多?)。同濟堂2013年中同比2012年中增長了21%和94%,但環比2012年下半年下降了12%和63%。我估計同濟堂有一些季節性,下半年業績好於上半年,但2012年應該是有業績粉飾的,可能早在國藥收購盈天時就已經接觸同濟堂了。
所以,2013全年570的業績毫無亮點,收入13.9億人民幣,利潤1.98人民幣,包括盈天全年和同濟堂11-12二個月的業績。我們簡單加總一下,盈天2012年收入12.7億港幣,利潤2.07億港幣,同濟堂2012年收入12.7億港幣,利潤1.69億港幣,同濟堂除以6算2個月,合計收入就是14.8億港幣,利潤2.35億港幣,折算成人民幣後是12億元和1.88億元。
對照前述2013年570的業績,2013年的業績同比2012年收入增長16%,利潤僅增長5%,若考慮同濟堂可能有季節性,下半年業績比上半年好,那麽2013年就沒有增長。之所以增速相比2012年急劇下降,原因就是2012年盈天和同濟堂的利潤水份太大。
現在我們回過頭來看2014年中報業績,收入12.6億元人民幣,利潤1.89億人民幣。對照2012年盈天和同濟堂的合計收入25.4億港幣和3.76億港幣,即人民幣20億元和3億元,除以2後,收入和利潤都增長了26%。
對照2013年中盈天和同濟堂的合計數,收入為6.34億港元+5.38億人民幣,利潤為0.785億港幣+0.495億人民幣,分別為10.45億元和1.123億元,分別增長了21%和68%。
若對照2011年的盈天和同濟堂,合計收入19.3億,利潤1.17億港幣,折人民幣分別為15.4億元和0.94億元,除以2即是7.7億和0.47億元。收入3年複合增長率為18%,利潤複合增長率高達60%!
假設2013年的真實利潤比2012年應該增長50%,那麽分別將2012年利潤調低將13年調高,則2014年中報的利潤同比13年中應該也還有40%左右的增長。
考慮到570的成長性,我估計全年收入會超過25億人民幣,利潤會超過4億人民幣,對應目前的PE為17倍,PB2.3倍。再考慮到中報里提到的將繼續收購心腦血管、腫瘤、骨傷科及針對老年人疾病的中藥企業,目前的估值應該是偏低的。
聲明:本人持有中國中藥。
中國中藥:收購行業稀缺龍頭標的 競爭力影響幾何?
來源: http://www.gelonghui.com/portal.php?mod=view&aid=1370|
本帖最後由 晗晨 於 2015-2-10 09:15 編輯 中國中藥:收購行業稀缺龍頭標的 競爭力影響幾何? 作者:首募錢厚 導讀:中國中藥自2013年2月後成為國藥集團旗下唯一的中藥整合平臺,國藥做大做強中藥產業的願景非常強烈。此次公司公告擬收購的江陰天江藥業屬於中藥配方顆粒行業,該行業過去7年保持了55%的複合增速,而此次收購對價僅為天江藥業2014年凈利潤的15倍PE,公司可謂是低價收購優質行業中的優質資產。公司原產品線核心競爭力也很明顯,擁有超過100個的基藥產品,其中7個獨家,隨著盈天醫藥和同濟堂兩個銷售團隊整合後的協同效應顯現,公司有望保持高增長。假設公司2015年年中完成對天江的並表,預期2014-2016年EPS為0.20,0.25,0.32港元。近期醫藥行業受湖南新一輪招標總體降幅超10%的事件影響,股價回調較多,但我們基於對公司核心競爭力及高增長的預期,我們給予公司2015年24倍PE,目標價6.0港元,較目前4.86元港元有23%的漲幅空間。 正文 核心關註點:

一、公司概覽:國藥集團控股,是其唯一的中藥整合平臺 公司資產主要包括盈天醫藥及同濟堂(於2013年11月並表)及即將收購的天江藥業資產,2013年同濟堂收入約12億元,盈天醫藥收入約10億元,公司總的收入為22.73億元,公司總的毛利為13.9億元,公司總的凈利潤為3.13億元,其中同濟堂的凈利潤為1.73億元。2014年上半年公司實現營業收入12.63億元人民幣,去年同期為5.17億人民幣,忽略季節性因素,由於2013年11月並表了同濟堂,所以實際同比增長15%左右。 自2013年2月後,公司的控股股東是國藥集團,而國藥集團是中國最大的醫藥集團,在醫藥商業、醫藥工業、新藥研發方面實力突出,公司是國藥集團旗下唯一的中藥整合平臺,從控股公司後的兩大筆收購事項(同濟堂及天江)來看,國藥做大做強中藥產業的願景非常強烈。 公司於1993年在港交所上市,至今兩次易名,並有較多資本動作,下圖為我們梳理的公司的重要發展歷程。 
二、天江藥業收購評價:收購對價有吸引力,預期增厚公司EPS 2015年1月27日公司公告稱公司擬收購江陰天江藥業有限公司81.48%的股權。總代價不應少於人民幣75.96億元及不應高於人民幣83.46億元。總的估值約為天江藥業2014年凈利潤的15倍PE。公司目前估值約為25倍PE,天江收購將增厚公司EPS,降低公司估值水平。同時,天江的盈利能力遠高於公司原有資產盈利能力,2013年銷售凈利率22%高於公司的15%,並且A股上市公司紅日藥業其接近一半的業務為中藥配方顆粒,其2014年PE預計為35倍,遠高於公司的對價估值水平。 天江藥業2013年合並營業收入達到25億元人民幣,凈利潤為5.46億元,均高於盈天和同濟堂的合計,由於是收購81.43%的股權,天江藥業的收入貢獻將達到一半左右,利潤貢獻或超過一半的權重。中藥配方醫藥行業的增長和盈利都有較好的發展勢頭,天江藥業又是該行業的龍頭公司,且此次對價相對市場可比公司估值較低。在此,我們回顧下紅日藥業收購北京康仁堂後的表現:紅日藥業自2010年4月-2012年2月期間分三次收購康仁堂100%的股權,康仁堂收入從2009年的 6000 萬增長到213年的8億,複合增速達到91%,紅日藥業市值從相應的從50億增長到了150億。所以,綜合來看,此次收購對公司屬於重大利好。 三、中藥配方顆粒行業分析:供給需求同步提升,強者恒強,天江藥業將迎來高速發展期 1.中藥配方顆粒行業發展概況 中藥配方顆粒為中藥的一種形式,中藥材經現代提取及濃縮技術處理後可得到中藥材提取物的配方顆粒。它保證了原中藥飲片的全部特征,能夠滿足醫師進行辨證論治,隨證加減,藥性強、藥效高、同時又具有不需要煎煮、直接沖服、服用量少、作用迅速、成份完全、療效確切、安全衛生、攜帶保存方便、易於調制和適合工業化生產等許多優點。 據中金公司的研報稱,中藥配方顆粒行業市場規模從2006年的2.3億增長到2013年的50億,複合增速達到了55%。 
2.中藥配方顆粒行業增長的驅動因素分析 (1)產品優勢特性決定了其替代能力 1)有效回避操作不當影響療效的情況 中藥配方顆粒代替中藥飲片用於臨床,從而根本改變了幾千年來中藥飲片以根、莖、葉、花、果實等直接入藥煎煮的方法,同時患者即沖即服,回避了煎煮過程,在這個工序中,操作者對加水量、浸泡時間、火候、煎煮時間、先煎、後下等技術操作不當時可能影響療效。 2)便於服用、攜帶 中藥配方顆粒經科學處理,服用時不需煎煮,只需按醫師處方以開水沖服即可,從而減少人力,節省了時間,方便病人服用。又由於體積小,攜帶更方便,最適於旅途服用和工作繁忙、無時間煎煮的患者、急重癥患者服用。 3)便於保管、調配 中藥配方顆粒采用鋁泊袋包裝,不易吸潮,避免了中藥貯藏、保管不當帶來的走油、變色、蟲蛀、黴變等質量問題,減少了汙染,方便保管。由於其包裝袋上都標明了與原生藥的換算關系,調配更加方便、衛生快捷,可避免傳統中藥手抓、秤稱帶來的分劑量誤差,也改觀了傳統中藥房給人臟、亂、累的現象。 (2)產品滲透率尚處於極低的水平 據國家統計局數據顯示,2013年中藥配方顆粒的市場規模僅相當於中藥飲片的5%,或中成藥的1%,滲透率極低。日本的中藥配方顆粒在中藥(不包括中成藥)中占比達到80%,臺灣地區也達到2/3,而內地目前占比不到 5%,未來發展空間巨大。 (3) 預期一些限制將放開 根據《中藥配方顆粒管理暫行規定》,使用中藥配方顆粒的臨床醫院需要在省藥監局備案,在北京,中藥配方顆粒只能在二級及以上中醫醫院使用。且中藥配方顆粒暫時未進入國家基本藥物目錄和全國醫保目錄。 中藥配方顆粒已經試點超過10年了,監管一直較嚴格,我們認為行業將迎來轉折點,使用範圍預期將逐步放開,部分產品也將進入國家基藥目錄及全國醫保目錄。這會成為行業快速增長的催化劑。 綜合以上因素來看,我們認為中藥配方顆粒行業未來5年能保持至少30%的複合增速。 3.中藥配方顆粒行業的競爭格局 (1)行業處於試點階段 :競爭小,毛利高 於2001年,國家藥監局頒布《中藥配方顆粒管理暫行規定》,僅允許選定的企業從事研發及生產中藥配方顆粒以及在試點醫院銷售中藥配方顆粒。至今,僅有六家企業獲國家藥監局批準,包括天江藥業及天江藥業全資控股的廣東一方,其余四家分別是康仁堂(紅日藥業全資控股)、華潤三九、新綠色、培力。由於只有6家企業參與競爭,政策性地降低了該行業的競爭性。行業毛利率處於較高的水平。 圖示:中藥配方顆粒行業毛利率高 
註:中藥配方顆粒數據為選取紅日藥業披露數據代替,紅日藥業全資控股康仁堂。 (2)天江在行業中的龍頭地位突出 天江及廣東一方合並後在行業中的領先地位更加得到鞏固,天江是該行業最早進入者,並且已經覆蓋到中國5000家醫院,銷售渠道已經建立起較強的壁壘,天江和一方合計市場份額2013年達到了50%,在行業中瑤瑤領先競爭對手。 
天江生產單味中藥配方顆粒的種類為700種,廣東一方為600種,領先於競爭者。 
(3)行業競爭將逐步放開:競爭將加劇,供給需求同步提升,有利行業龍頭公司發展 按照2001年頒布《中藥配方顆粒管理暫行規定》起計算,行業已經過了14年的試點階段,我們判斷行業將進入生產資格逐步放開的階段。這將使得更多的競爭者進入該行業。但同時,我們看到監管機構也將逐步放開中藥配方顆粒用藥的限制,並且有望將其收入國家基藥目錄及全國醫保目錄,這將使得需求快速擴張。在一個逐步放開的行業中,需求增加,已經在行業經驗、產品種類、研究實力、渠道網絡等方面建立起壁壘的行業龍頭公司將通過競爭優勢獲取更大的市場份額,即便價格水平有所下降,但量的增加將有較大的想象空間。 四、公司原產品線:核心競爭力突出,協同效應釋放,預計保持15%的增速 1.中成藥行業:增長較快,毛利小幅提升 公司原產品線以中成藥為主營,2014年半年報顯示公司主營87.1%為中成藥產品。2013年中成藥行業的營業額為5065億元,同比增長21.09%,利潤總額為538億元,同比增長21.40%。中藥行業近幾年的收入、利潤增長都超過了醫藥行業整體水平,收入增長率始終在20%以上,利潤總額的增長也多數時間在20%以上。 另外,在收入較快增長的同時,中成藥的毛利率從2011年8月之後處於不斷上升的趨勢,2011年8月為28.22%,2014年11月為32.64%。中成藥的毛利率主要和中藥材的價格密切相關。中藥材的價格從2011年6月之後出現下降,緩解了中藥企業的成本壓力,使得毛利近年保持穩健上升的態勢。 2. 公司核心資源雄厚:擁有超過100個的基藥產品,其中7個獨家;150個基本醫保目錄產品,26個獨家;共計擁有超500個中藥、西藥、生物藥品,獨家超60個 公司擁有超過100個的基藥產品,其中7個獨家,分別是仙靈骨葆、玉屏風顆粒、鼻炎康片、頸舒顆粒、潤燥止癢膠囊、棗仁安神膠囊和風濕骨痛膠囊。 2014年上半年,公司營收占比前5的產品均為獨家產品,總共貢獻公司64.20%的收入。 由於獨家產品的壟斷優勢,公司的收入增長有較強的保障。 
3.重點產品增長預期:盈天與同濟堂的協同效應將顯現,保證公司產品綜合達到15%以上的增速 (1)仙靈骨葆:2014年上半年同比增長34.60%,增長較快。該產品公司覆蓋了997家醫院,覆蓋率達到了72%。但公司2014年的增長主要來自於新開拓的二級及基層醫院。目前三級醫院對該產品的貢獻仍然是最大的,二級醫院覆蓋率於2014年快速增長達到了69%。借助在三級醫院的成功,相信二級及基層醫院將不斷貢獻更多的收入。但由於二級醫院覆蓋率的提升已經在2014年貢獻了較快的增速,預計未來三年將逐步遞減,複合增速降低為13%左右。 (2)玉屏風顆粒:上半年同比銷售下滑1.90%,主要是受2013年上半年禽流感高基數影響所致。公司預計今年全年仍然能保持10%以上的增速。由於同濟堂的銷售團隊在醫院方面有優勢,盈天醫藥在OTC 渠道更有優勢,團隊的整合之後,銷售可以互補。玉屏風顆粒產品為原盈天醫藥的獨家產品,我們預計未來玉屏風顆粒在醫院渠道將有較大的增長空間。目前玉屏風顆粒產品在三級醫院的覆蓋率46%左右,二級醫院則只有37%。相比較同濟堂的主打產品仙靈骨葆的覆蓋率,有較大的成長空間。我們相信經過2年的合並磨合之後優勢互補的協同效應將顯現,玉屏風顆粒將提升在各級醫院的覆蓋率,在未來3年能保持15%的增速。 (3)鼻炎康片:2014年上半年營收同比增長5.80%,增速較低。鼻炎康片也是原盈天醫藥的獨家產品之一。目前鼻炎康片在醫院的覆蓋率更低,三級、二級醫院分別為7%及16%,上升空間巨大。我們認為隨著兩個銷售團隊的整合結束,2015年開始該產品有望保持20%的增速。並且該產品於2014年5月進入了國家低價藥目錄,這可以支持公司對其提價,毛利率有望提升。 (4)其他產品:公司擁有26個獨家醫保產品,這樣龐大的資源壟斷優勢,將促使公司產品保持較高增速,2014年上半年,公司其他產品增速達到了42.20%,表明了公司的獨家資源將逐步被開發,增長後勁十足。由於這部分產品基數低,隨著銷售渠道協同效應的顯現,管理層對該部分品種的重視,預計未來3年能保持20%以上的增速,對公司營收的貢獻度將逐步提升。 五、盈利預測與估值
1) 公司收購天江對價為100億港元,全部對價均按4.5港元/股增發或直接支付,公司新增股本22.22億。 2) 收購完成時間為2015年7月1日,並於當日開始並表。利潤按50%的權重計入2015年報表,計算EPS時所用股本按時間加權平均計算。 3) 2015及2016年原產品營收增速為18%和15%,天江增速為30%和30%。

Ø 估值:2015年24倍PE,給予買入評級,目標價6.0港元 基於上文分析、關鍵假設等測算,我們預期2014-2016年公司EPS為0.20,0.25,0.32港元,4.86港元的價位對應2015年PE僅為19.44倍,較低估。可比公司2015年預期平均市盈率為20.24倍,基於公司的核心競爭力及中藥配方顆粒的行業高增速,我們給予公司2015年24倍高於市場平均的PE,12個月目標價6.0港元,對應漲幅23%。 
|
迪化街中藥大抽查 三款中藥含禁藥 你服用的到底是中藥還是農藥?
2015-05-25 TCW中藥向來被國人視為養生、治病的聖品,但由於九成五仰賴進口,源頭難以把關,品質良莠不齊。正當台灣人「聞進口茶色變」之際,《今周刊》追查發現,中藥果然亦有嚴重的農藥殘留問題,而且問題不比進口茶來得小!
撰文•李建興
正當全民深陷「茶安風暴」時,國人賴以養生的「中藥」,恐怕也不安全!根據《今周刊》的檢驗與調查,無論是市場、中藥行販售的中藥材,或被坐月子中心、薑母鴨、藥燉排骨店拿來入菜用的藥方,在你還沒得到養生、治病的功效時,可能已先吞下了二、三十種農藥!
今年四月,在政府全面查緝劣質茶時,就意外發現部分中藥行的產品也有農藥殘留問題,當時,一位中醫診所院長也向本刊透露,許多流通在市面上的中藥材,由於把關不足、品質堪憂,「劣質藥材問題,絕對比你我想像中的嚴重!」另外,根據中藥商公會全國聯合會估計,國內有九成五的中藥材仰賴進口,僅去年就進口了三.二三萬噸的中藥材,因此,在全民聞「進口茶」色變之際,本刊認為,幾乎全靠進口的「中藥」,更值得關心,於是展開一系列的調查。
本刊於四月二十二日前往台北市迪化街一帶中藥行,採買菊花、人參、川芎、枸杞等十九款中藥材,分別針對重金屬、黃麴毒素和農藥進行送驗。
發現一:
菊花、枸杞樣本驗出禁藥
最後,有三款樣本驗出農藥,其中,不僅全有「不得檢出」的禁藥,其餘所含的農藥則有嚴重超量的問題,最高甚至超標六十五倍;另外,農藥殘留支數也過多,其中一個樣本存在三十六支農藥,不免令人擔憂,這到底是吃補還是吃農藥?
在禁藥部分,本刊送驗的菊花(樣本一),就驗出了七支不得檢出的農藥,而兩個枸杞(樣本二、三)則各有兩支及一支禁藥。
其中,三款樣本都驗出的毆蟎多,經長庚腎臟科醫師顏宗海分析,竟是高毒性農藥,且經動物實驗過量攝入可能會導致腸癌,美國環保署更視為B級致癌物(分四級,A級最危險),而大克蟎和派美尼則為C級致癌物,動物實驗分別發現可能增加肝癌和甲狀腺癌的風險。
至於農藥超量方面,本次驗出的部分農藥,雖可以使用,卻嚴重超出容許值。
發現二:
允許使用的農藥也超標
送驗的菊花有十九支農藥超標,最嚴重的四氯異苯晴含量竟比容許值高出六十五.六倍;而芬普尼則超標五十九倍,其餘撲克拉、待克利、依普同、普克利,超標倍數也都高達三十倍以上。
顏宗海提醒,四氯異苯晴是高毒性,世界衛生組織視為第二級致癌物(分四級,第一級最危險),動物實驗已證明有致癌風險,而超標三十倍以上的芬普尼、撲克拉、待克利、依普同、普克利則皆在動物實驗中發現可能致癌。
發現三:
一款藥材竟含三十六種農藥值得注意的是,這次送驗的菊花,不但嚴重違反國家標準,同時驗出三十六種農藥,其中還有二十六種不合格(包括七種不得檢出、十九種超標)。
據二○○六年美國加州大學研究發現,當田間多種農藥混合使用,就算劑量按照規定,卻因為混合支數過多,最後仍讓田裡三成五的青蛙死亡,存活下的則有發展遲緩的問題。
對此,新光醫院腎臟科醫師江守山則十分無奈,「連醫師開藥時,都會要求病人先暫停服用中的藥,避免新舊藥同時使用,產生化合作用,擴大藥性,對人體造成龐大負擔,而我們卻在不知不覺中一次吃下三十六種農藥,其中還有二十六種超標!」目前《今周刊》已將送驗結果送交主管機關衛生福利部食品管理署,而市面上的中藥,是否也像這次的「茶安風暴」將有更多黑心廠商現形,我們靜待政府的查緝結果!
小心!你服用的中藥裡含有劇毒農藥!
《今周刊》送驗中藥結果如下:樣本一 菊花:驗出36種農藥,26種不合格農藥 檢出量(ppm) 國家標準
(ppm)
大克蟎(C級致癌物) 0.45 不得檢出安殺番硫酸鹽 0.35 不得檢出芬佈賜 0.10 不得檢出護矽得 0.09不得檢出毆蟎多(B級致癌物) 1.82 不得檢出畢達本 0.59 不得檢出派美尼(C級致癌物) 1.58 不得檢出四氯異苯晴(2級致癌物)6.65(超標65.6倍) 0.1* 芬普尼(C級致癌物) 0.121(超標59倍) 0.002* 撲克拉(C級致癌物)2.47(超標48.4倍) 0.05* 待克利(C級致癌物) 2.44(超標47.8倍) 0.05* 依普同(B級致癌物)1.76(超標34.2倍) 0.05* 普克利(C級致癌物) 1.64(超標31.8倍) 0.05* 達滅芬 14.43(超標27.86倍)0.50 普拔克 13.61(超標26.22倍) 0.50 α-安殺番 0.80(超標15倍) 0.05* 賜派芬(B級致癌物)0.68(超標12.6倍) 0.05* 撲滅寧(B級致癌物) 0.66(超標12.2倍) 0.05* β-安殺番 1.16(超標10.6倍)0.1* 得克利(C級致癌物) 0.49(超標8.8倍) 0.05* 貝芬替(C級致癌物) 8.78(超標7.78倍) 1.00 剋安勃0.38(超標6.6倍) 0.05* 脫芬瑞 0.19(超標2.8倍) 0.05* 毆殺斯(C級致癌物) 0.11(超標1.2倍) 0.05* 亞滅培 4.54(超標1.17倍) 2.00 菲克利(C級致癌物) 0.10(超標1倍) 0.05* 樣本二 枸杞1:驗出9種農藥,4種不合格農藥 檢出量(ppm) 國家標準(ppm) 大克蟎(C級致癌物) 0.03 不得檢出毆蟎多(B級致癌物)0.09 不得檢出克芬蟎(C級致癌物) 0.03 0.02* β-安殺番 0.05 0.04* 樣本三 枸杞2:驗出9種農藥,2種不合格農藥檢出量(ppm) 國家標準(ppm) 毆蟎多(B級致癌物) 0.04 不得檢出待克利(C級致癌物) 0.04 0.02* 資料來源:顏宗海醫師提供,綜合世界衛生組織(WHO)、美國環保署、 美國國家毒理研究中心(NTP)等機構。
註:
1. 致癌性分法為二:WHO依嚴重性分1至4級,美國環保署則依序為A至D級,其中A為確定致癌物、B為可能致癌物、C為經動物實驗可能增加致癌風險、D不會致癌。
2. *表示容許值跟隨偵測極限而定。
神威药业(2877):现代中药行业龙头企
http://gelonghui.com/#/articleDetail/13292
作者:李博
“三个最大”奠定了公司在现代中药领域内的龙头地位:截至2014年,(1)神威药业注射液的年产量达32亿支,按照生产量计算,公司为中国最大的中药注射液生产商;同时,以销售量计算,目前公司是中国最大的清开灵注射液和参麦注射液生产商;(2)公司的软胶囊产品年产量达35亿粒,以销量及产量计算,公司为中国最大的中药软胶囊生产商;(3)公司的颗粒产品年产量达34亿袋,若同样以销售量和产量计算,公司为中国最大的中药颗粒产品生产商。我们认为上述“三个最大”奠定了神威药业在现代中药行业中的领先地位,从长期来看,公司将分享现代中药行业的增长。
受产品结构、销售管道以及招标降价等因素影响,公司在在2015年将保持缓慢发展,增长速度低于医药行业平均增速:受产品结构、销售管道以及招标降价等因素影响,我们预期神威药业在2015年 的增长速度较为有限。以中药注射液为例,这些产品主要在诊所、社区医院等基层医疗曙构销售,这便意味着,这些产品的价格(尤其是清开灵注射液和参麦注射 液)都受到各地区新一轮招标价所限制,未来价格继续受到控制,增长曙会不大;在销量方面,由于三大主力产品清开灵注射液、参麦注射液及舒血宁皆为老牌产品 (清开灵注射液和参麦注射液的销售时间超过20年,舒血宁销售时间超过10年),在管道方面已经较为成熟,只能寄托于拓宽基层医疗曙构的深度来提高销量。我们预期公司在2015年的收入仅能上升约3.4%,低于市场平均预期5.6%。而根据Euromonitor的预测,在2015年-2018年期间,中国医药行业复合年均增长率(CAGR)为11.7%。
未来可能出现的催化剂: 就其现有业务而言,我们认为公司在未来一年中不会出现较明显的催化剂。然而,受到外部市场及中药配方颗粒市场开放的影响,公司在未来的股价有望得到正面刺 激。首先,下半年深港通的开放以及可能出现的沪港通扩容会对公司整体估值形成利好;其次,随着中药配方颗粒市场的不断开放,公司的相关业务会得到进一步扩 张,有助于其利润的进一步提升。
首次覆盖并予以中性评级:基于DCF模型,从长期来看我们认为神威药业的合理股价为14.41港币,对应2015年13.5倍市盈率;但受到业绩增速放缓影响,公司股价于短期内可能存在下行压力,投资者应当予以留意。
现代中药行业龙头
截至2014年,(1)神威药业注射液的年产量达32亿支,按照生产量计算,公司为中国最大的中药注射液生产商;同时,以销售量计算,目前公司是中国最大的清开灵注射液和参麦注射液生产商;(2)公司的软胶囊产品年产量达35亿粒,以销量及产量计算,公司为中国最大的中药软胶囊生产商;(3)公司的颗粒产品年产量达34亿袋,若同样以销售量和产量计算,公司为中国最大的中药颗粒产品生产商。我们认为上述“三个最大”奠定了神威药业在现代中药行业中的领先地位,从长期来看,公司将分享现代中药行业的增长。
得 益于高标准规范化生产,公司中药产品的安全性较高,未来出现安全事故的概率较低作为中国最大的中药注射液生产商,神威药业的传统核心产品主要为中药注射 剂。中药注射剂是以中医药理论为指导,采用现代科学技术和方法,从中药或天然药物中提取有效成分供注入人体,具有生物利用度高、作用迅速等特点,能较好的 发挥药效。随着科技的发展和对传统中药认识的不断提高,中药注射剂越来越得到广泛接受。
但值得留意的是,在行业发展初期,受审评标准不严的影响,同一中药注射剂下有多家厂商拥有生产批文,部分在较早年度获批生产中药注射液的厂商,其工艺不达标,这便导致当前中药注射液市场参与者的层次良莠不齐,产品安全存在隐患。例如,今年4月,由于个别患者出现寒战、发热等症状,苏中药业召回3万余支生脉注射液。作为行业龙头,神威药业的品质规范一直走在行业最前列,公司的所有生产线都已经全面通过了新版GMP认证。在2014年,公司获得年度“全国医药行业品质管制小组活动优秀企业”、“河北工业大奖---中药注射剂品质标准化高技术产业示范工程”等奖项。此外,公司还获评为“国家技术鄪新示范企业”、获得国家发改委批准,成为中药注射剂新药开发技术国家地方联合工程实验室,该实验室为国内首个唯一一个中药注射剂技术领域的国家地方联合工程实验室。
我们认为,公司通过不断加强品质把控,促进了企业品种管制体系的提升,其产品安全性较高,未来出现安全事故的概率较低。
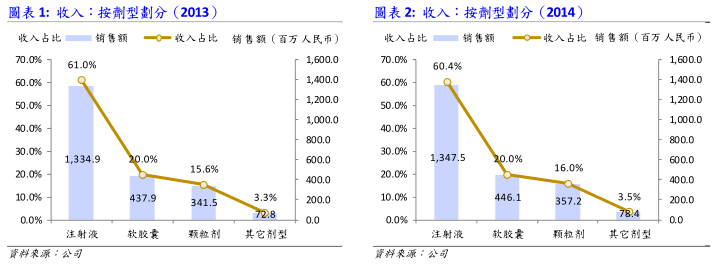
关于公司主要核心产品公司的产品主要分为三类,即:注射液产品、软胶囊产品以及颗粒剂产品。其中,注射液类核心产品包括清开灵注射液、参麦注射液、舒血宁注射液;软胶囊类核心产品包括五福心脑清软胶囊、藿香正气软胶囊;颗粒类核心产品包括小儿清肺化痰颗粒、滑膜炎颗粒等。*清开灵注射液:该款产品为公司的老牌产品之一,于1993年7月获得生产许可,属于复方中药注射液;主要治疗病毒性疾病,包括呼吸道感染、病毒性肝炎、脑出血及脑血栓等。另外,清开灵注射液于2010年被纳入全国处方基药,按照销售量和销售额计算,神威药业是中国目前最大的清开灵注射液生产商。在近两年,该款产品大约占公司全部收入的25%左右。
*参麦注射液:该款产品亦为公司的老牌产品之一,分别于1993年7月及及1995年6月获得20毫升和10毫升的生产许可证,属于复方中药注射液,主要治疗冠心病、病毒性心肌炎以及心肺疾病等。该款产品为《国家基本医疗保险及工伤保险药品目录》和《基本药物目录》药品。以销售量计算,神威药业为中国最大的参麦注射液生产商,在近两年,参麦注射液大约占公司收入的10%-15%左右。
*舒血宁注射液:该款产品为公司的三大核心注射液产品之一,属于单方中药注射液,主要治疗心脑血管疾病等。该款产品为《国家基本医疗保险及工伤保险药品目录》,在近两年内,舒血宁注射液大约占公司收入的10%-15%左右。
*五福心脑清软胶囊:该款产品为国内十大心脑血管病口服中药之一,主要用于预防及治疗冠心病及动脉硬化。另外,在同类心脑血管疾病治疗用药当中,五福心脑清软胶囊属于平均日服价格较低的品种并且该款产品在部分省份中属于医保用药。近两年内,五福心脑清软胶囊大约占公司收入的10%左右。
*小儿清肺化痰颗粒:该款产品为公司的主要OTC颗粒产品之一,为儿童止咳化痰类用药,主要在零售药店中出售。
业务上下游关系在上游,公司主要通过同供应商的长期合同、指导供应商进行生产从而采购中药植物;在中游,公司主要通过位于河北的生产基地进行注射液、软胶囊、颗粒及其它剂型产品的生产;在下游,公司主要通过分销商进行产品的销售。

公司产品结构、销售管道及经营策略导致其主营业务在在2015年不太可能出现爆发性增长曙会
受到产品结构、销售管道及经营策略的影响,我们认为公司的主营业务将在2015年继续保持缓慢发展。
在产品结构及销售管道方面:
*注射液类产品:近两年,这部分产品的收入占公司全部收入的大约60%, 并且基本上都走低端路线,主要在诊所、社区医院等基层医疗曙构销售。这便意味着这些产品的价格(尤其是清开灵注射液和参麦注射液)都受到各地区招标所限 制,未来增长曙会不大;在销量方面,由于三大主力产品清开灵注射液、参麦注射液及舒血宁皆为老牌产品(清开灵注射液和参麦注射液的销售时间超过20年,舒血宁销售时间超过10年),在管道方面已经较为成熟,只能寄托于拓宽基层医疗曙构的深度来提高销量。我们预期公司注射液类产品在2015年的销售额上仅能维持单位数上升。
*颗粒剂产品:这部分产品主要为OTC类,其价格上升空间要大于传统注射液类产品。另外,受益于OTC产品管道的扩张(公司计画于2015年零售药店的覆盖数量从2万家上升到3万家),我们预期这部分产品销售额在2015的增长速度会达到10%。
*胶囊类产品:受益于OTC产品管道的扩张,OTC胶囊类产品在2015年也会达到双位数增长。但由于该板块受到处方类胶囊产品销售的限制,我们预期整个胶囊类板块在2015年销售额也仅保持单位数增长。
在经营策略方面:
*公司计画加强强OTC类产品和大健康类产品的开发和销售。具体来讲,公司计画在研发和销售两方面下手,推出更多的OTC产品及大健康产品,扩大产品销售管道,增大铺售药店零售规模(公司计画从当前铺售的2万家药店扩张到3万家药店)。但我们认为,受制于相关行业竞争的压力及公司OTC/大健康类产品的收入占比,这部分产品的增长不会给公司2015年业绩带来太大惊喜。
*每年增加高端核心处方药品种。具体来讲,公司计画通过采用研发和收购的模式引进更多的中高端处方药品种。我们认为这两种模式也不会给公司2015年 的业绩带来太大冲击。首先,一个产品从研发、临床试验、获得生产批文到各省招标、销售管道的铺开耗时较长,绝非一两年之内可以完成;其次在收购方面,由于 从药品的甄选到收购的完成都耗时较久,要形成多种收购药品的大规模收入贡献也需要较多时间。所以,新品种处方药亦不会对公司2015年业绩形成较大利好。
大乡资金南下及中药配方颗粒市场的开放有助于公司估值的提升:
虽然公司的主营业务在2015年不会有太多惊喜,但我们认为大乡资金南下和中药配方颗粒市场的开放会给公司带来估值上升的曙遇.
我们认为,深港通的开通几乎已成定局,届时大乡资金将进一步涌入香港市场。此外,未来沪港通还会有可能扩容至中下盘,加速提升港股市场中部分股票估值。作为恒生综合中型股指数成分之一,神威药业极有可能受惠于此。
另外,在当前中药配方颗粒市场中,仅有5家公司拥有全国牌照进行生产和销售。市场预期中药配方颗粒市场将在未来两年中逐步开放。届时,作为现代中药行业龙头,神威药业会逐渐扩大中药配方颗粒的生产,进而有助于收入和利润的提升。综上,我们认为配方颗粒市场的开放也会给公司估值的提升带来新机遇。
财务模型假设及估值:
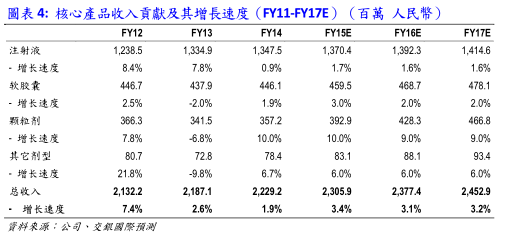
我们预计2015年的整体收入同比增长3.4%至人民币约23.1亿元,理由如下:
*中药注射液板块:该板块在2014年受招标调价影响较大,收入为13.5亿,仅上升0.9%;我们认为“低速增长”这一情况会在该板块出现。结合其销售管道的稳定性,我们预测该板块收入会在2015年录得1.7%的上升,达到约13.7亿人民币.
*软胶囊板块:该板块收入在2014年录得1.9%的增长,达4.5亿人民币。受益于不断扩张的药店覆盖范围,该板块的OTC药品将有较快速增长。我们预测该板块在2015年的收入将会达到4.6亿人民,同比上升3%.
*颗粒剂板块、其它剂型板块:类似的,颗粒剂板块和其它剂型板块也将受益于不断扩张的药店覆盖范围,我们认为颗粒剂板块的收入将会保持去年增速,在2015年同比上升10%,达到约3.9亿人民币;而其它剂型板块收入将在2015年同比上升6%,达到约8300万人民币的水准。
其它关键假设:
*分销占收入比重:鉴于公司当前处于转型时期,随着产品结构的调整以及OTC产品增速的加快,我们预测其于2015年分销占收入的比重将从2014年的18.5%上升至20%。
*行政费用:当前,由于新业务及管理团队的扩大,我们预计公司在2015年的行政费用会同比增长9.5%,达到3.1亿人民币。
DCF模型:
*由于公司未来收入较为稳定、增幅不大,我们认为采用现金流折现法更能估算出公司的真实价值。下表为我们所做的DCF假设及模型结果:
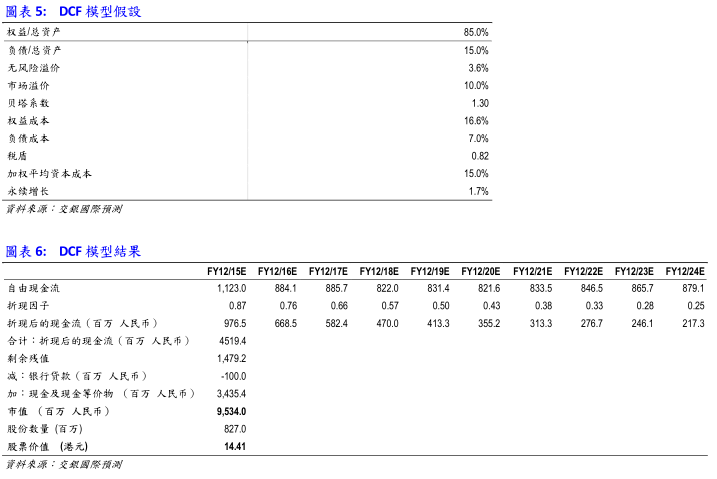
估值:综上,从长期来看我们认为公司的合理估值约为95.3亿人民币,对应2015年的市盈率约为13.5倍。目标价为14.41港币,仍有10.5%的上升空间。但受到业绩增速影响,公司股价于短期内可能存在下行压力,投资者应当予以留意。
来源:交银国际
格隆汇声明:文章系格隆汇转载文章,代表其特定立场和看法,不代表格隆汇观点。格隆汇作为免费、开放、共享的海外投资研究交流平台,并未持有任何关联公司股票。
山西中藥企業抽檢發現蘇丹紅
來源: http://www.yicai.com/news/2015/06/4630940.html山西中藥企業抽檢發現蘇丹紅
一財網 彭海斌 2015-06-11 10:36:00
據山西省食品藥品監督管理局網站披露,在該省局組織的中成藥染色專項抽驗中,經山西省食品藥品檢驗所檢驗山西華康藥業股份有限公司生產的骨筋丸膠囊(批號為:20150101)檢出蘇丹紅Ⅰ、蘇丹紅Ⅳ。
在醫藥監管部門對制藥企業的抽檢過程中,再次檢出蘇丹紅殘留。這已經是這種有明顯毒性的化學染色劑今年二次被檢出。
據山西省食品藥品監督管理局網站披露,在該省局組織的中成藥染色專項抽驗中,經山西省食品藥品檢驗所檢驗山西華康藥業股份有限公司生產的骨筋丸膠囊(批號為:20150101)檢出蘇丹紅Ⅰ、蘇丹紅Ⅳ。
蘇丹紅的化學成份中含有一種叫萘的化合物,該物質具有致癌性。蘇丹紅常被使用於劣質血竭等藥材的非法染色。毒理學表明,蘇丹紅對人體具有明顯毒性作用,在中藥材、中藥飲片和中成藥中均不得檢出。
據華康藥業網站介紹,該公司始創於1988年,是國內規模最大的現代化中成藥生產企業之一。目前該公司共生產8個劑型11大系列180余個品種。擁有國家中藥保護品種8個,國家級新藥3個,國家基本藥物目錄產品57個。

華康藥業生產的骨筋丸膠囊主要用於活血化瘀、舒筋通絡,其成分包含了乳香、沒藥、血竭、馬錢子等。照此看來,此次檢出的蘇丹紅可能來自於血竭成分。
山西省藥監局目前責成負有管轄權的運城市藥監局直接立案調查並依法嚴厲查處,並要求後者按照《藥品質量抽查檢驗管理規定》開展相關核查工作,監督企業召回涉事批次的所有上市藥品,查清流向,確保召回到位,並予以監督銷毀;暫停涉事品種的生產,在未查清原因、徹底整改到位前,不得恢複生產。如發現企業購進的中藥飲片存在非法染色、摻假問題,要追根溯源,直至追查到違法源頭;對涉嫌犯罪的,要及時移送公安機關,並按照食品藥品行政處罰案件信息公開相關規定,及時公開案件查處結果。
這是今年來第二起制藥企業抽檢中發現蘇丹紅殘留。2015年2月15日,國家食品藥品監督管理總局在全國範圍內組織對風濕關節炎片和跌打丸2個品種進行了專項監督抽驗,分別從藥品生產、經營和使用環節抽取了158批次跌打丸和155批次風濕關節炎片。經青島市食品藥品檢驗檢測中心按照補充檢驗方法檢驗,發現山西旺龍神農藥業有限公司生產的2批跌打丸檢出蘇丹紅I和蘇丹紅Ⅳ。
值得註意的是,此次被抽檢出蘇丹紅殘留的華康藥業2014年11月7日全面通過新版GMP(Good Mmanufacturing Practices)認證。GMP是一套適用於制藥、食品行業的強制標準,要求企業的原料、人員、設施、生產過程等方面達到國家規定的衛生治療要求。中國新版的GMP於2011年開始實施,經審核達到標準後,由食藥監部門頒發《藥品GMP》證書。
中藥抽檢過程中發現殘留問題,今年屢現報端。2013年有環保組織抽查了9家著名中藥企業,發現超七成含有農藥殘留。
目前,山西省食藥監局已經對華康藥業案件掛牌督辦,並要求相關查處情況於2015年7月10日前報告省局。

更多精彩內容
關註第一財經網微信號
中國藥典再升級 中藥標準更嚴
來源: http://www.yicai.com/news/2015/06/4634424.html中國藥典再升級 中藥標準更嚴
一財網 馬曉華 2015-06-19 09:30:00
為推動《中國藥典》2015版的順利實施,食藥監總局還將會針對性的加大一些監督檢查的力度,使上市的品種能夠符合藥典的要求。特別是要加強一些‘飛行檢查’的力度,加強專項抽驗等行之有效的措施和方法。
6月18日,國家食藥監總局發布2015版《中國藥典》。這個涉及到藥企藥品研制、生產、經營、使用和管理,且是國家藥品標準體系的核心在2010年的五年後再升級。
新版藥典嚴厲升級
《中國藥典》是為保證藥品質量所制定的質量指標、檢驗方法以及生產工藝的技術要求,是藥品研制、生產、經營、使用和監督管理部門遵循的法定依據。
“習總書記要求用‘四個最嚴’來切實加強食品藥品安全監管,在‘四個最嚴’中首當其沖的就是最嚴謹的標準。很多時候,標準缺失或標準不嚴謹往往就是系統性風險的誘因。藥典標準直接反映了一個國家的藥品先進水平和藥品質量安全狀況。新版藥典在品種收載、檢驗方法完善、檢測限度設定以及質量、安全控制水平上都有了較大提升。新版藥典編制修訂工作已經全部完成,將於近日頒布,於2015年12月正式實施。”國家食藥監總局新聞發言人顏江瑛在新聞發布會上表示。

據了解,2015年版《中國藥典》在歷版藥典的基礎上,堅持保障公眾用藥安全的原則,在品種收載、檢驗方法完善、檢測限度設定以及質量控制水平上都有了較大提升,重點加強藥品安全性和有效性的控制要求,充分借鑒國際先進質量控制技術和經驗,整體提升藥典標準水平,全面反映我國當前醫藥發展和檢測技術的水平,集中體現了當前我國藥典標準的最新科研成果,將在推動我國藥品質量提高、加快企業技術進步和產品升級換代、促進我國醫藥產業結構調整、提升《中國藥典》權威性和國際影響力等方面發揮重要作用。
“藥典的作用,一是維護公眾健康,保障用藥安全有效的‘防護墻’;二是發揮引領產業結構調整和產品質量升級的‘導航儀’;三是發揮提升企業競爭力的‘助推器’;四是發揮中國制藥實現質量硬承諾,通向國際化道路的‘彩虹橋’作用。”顏江瑛表示。
據國家食藥監總局科技標準司司長於軍介紹,2015年版《中國藥典》收載品種總數達到5608個,比2010年版藥典新增1082個。本版藥典的一個重要變化是將一部、二部、三部的附錄進行了整合,增設為藥典第四部,使藥典分類更加清晰明確。
國家藥典委員會秘書長張偉這樣解釋新版藥典:新版藥典頒布使《中國藥典》標準又上了一個新臺階,主要有以下四個方面:第一,數量增加。這次總數量增加了20%以上,達到5608,比上一版增加1000多個。涵蓋了基本藥物、醫療保險目錄品種和臨床常用藥品,應當說更加適合於臨床用藥的需求。而且標準數量有了全面提升,特別是圍繞安全性和有效性的控制項目,增加了一些檢測項目。另外,檢測手段進一步的強化,並且更加多樣化。同時擴大了先進的分析技術的應用,提高了檢測方法的專屬性、靈敏性和準確性,同時又保留了一些簡便易行、經濟實用的常規檢測方法。新版藥典完善標準體系的建設,覆蓋了原料藥、輔料、藥品包材、生產過程等等,特別是加強質量全程管理的理念。新版藥典制定和修訂的指導原則和通用的技術要求,用於藥品的研發和生產過程、檢測終端各個環節,也包括了原料、輔料、包材等多個領域,總體上形成了比較完整的標準體系。
“新版藥典以解決藥品質量與安全的突出問題為導向,緊跟國際藥典標準發展趨勢,兼顧我國也藥品生產實際水平,著力提高藥品質量控制水平,通過提高標準要求和推動先進檢測方法應用發揮技術引領作用,淘汰落後生產工藝,現實產品升級換代和產業結構調整,使企業‘以標準促質量,以質量求生存’。”張偉表示。
據了解,自新版藥典實施之日起,已上市的藥品的質量標準就應當符合2015版《中國藥典》收載的品種項下的質量標準;對已經上市的但是在2015版藥典當中未收載的該品種質量標準,也應當符合《中國藥典》通則的相關要求;已經提交了註冊申請還沒有經過批準的藥品,在批準時也應該要求他們符合2015版藥典標準的相關要求。
“為推動《中國藥典》2015版的順利實施,總局還將會針對性的加大一些監督檢查的力度,使上市的品種能夠符合藥典的要求。特別是要加強一些‘飛行檢查’的力度,加強專項抽驗等行之有效的措施和方法,督促企業合法合規的按照藥典標準開展生產活動,保障藥品的安全有效。對不按照國家藥品標準生產的企業,監管部門將依法進行查處,情節嚴重的要吊銷生產許可,涉嫌刑事犯罪的將移送司法部門追究刑事責任。” 國家食品藥品監督管理總局藥品化妝品註冊管理司司長王立豐表示。
對於新版《中國藥典》將如何執行,顏江瑛表示,以中國藥典為主題開新聞發布,是為了告訴企業、告訴公眾,新版藥典公布後希望大家嚴格遵守藥典標準,維護法律權威。同時藥品監管部門也會按照新版藥典嚴肅查處不按標準執行的企業。最近總局幾次檢查發現問題,嚴肅查處,及時公布我們查處結果。將“四個最嚴”的執行體現在監管的每一個環節,標準就是一個最重要的依據。
中藥標準更嚴
近年來,中藥飲片不合格率一直高於西藥和中成藥,成為老百姓用藥的心頭隱患。雖然國家食品藥品監督管理總局在2013年開始出重拳打擊,規範中藥材市場,但是單純靠政府來監管是無法監管的過來。從標準上進行行業提升,也是新版藥典的一個重點。
“大家比較關心中藥標準中的重金屬、農藥殘留的問題。2015年版藥典在技術上也實現了多種重金屬有害元素的同時檢測,還針對重金屬在不同價態下的表現出不同的藥理、毒理作用和特點,也探索和制定了汞和砷等元素不同價態的檢測方法。可以下這樣一個結論,新版藥典在重金屬及有害物元素的檢測水平上已經達到了國際先進水平。”顏江瑛表示。
在新版藥典中,收載了氣相色譜串聯質譜法和液相串聯質譜法,與原來收載的氣相色譜法相比,具有更好的特異性和靈敏度,可以檢測出229種農藥殘留,為進一步加強中藥材的農藥殘留檢測種類以及檢測限度奠定了一個很好的基礎。
“我們和歐洲藥典(8.4版),美國藥典(38版)對植物藥建立了農藥殘留的限度標準相比,它們有70個限量要求,涉及到106種農藥。可以說中國藥典在農藥殘留檢測方面還是達到了很高的要求。”張偉表示。
另外張偉表示,中藥飲片、藥材,在種植、流通、儲藏過程中都會存在一些風險因素,針對這些可能存在的風險因素,新版藥典在中藥安全性方面重點加強了對二氧化硫殘留、農藥殘留、重金屬及有害元素,黃曲黴毒素、色素、微生物、內源性有害物質等,都增加了檢測項目。初步統計,新版藥典增加了四個中藥安全性的技術指導原則,增修訂七個與安全性相關的檢測方法。特別是在2010年版基礎上,又對30個品種的標準中分別增加了二氧化硫殘留、重金屬殘留、農藥殘留、黃曲黴毒素等檢測。
“舉兩個例子,比如對山藥和葛根這些藥材中,增加了二氧化硫的檢測,對珍珠、海藻等海洋類藥材增加了重金屬及有害元素檢測,對人參和西洋參增加了農藥殘留的檢測品種,從過去檢測9種增加到16種。另外,對柏子仁、蓮子、薏苡仁等14種中藥材增加了黃曲黴檢測,此外還對中藥註射劑規定了重金屬和有害元素的檢測以及限度標準。”張偉表示。
對於目前爭論的“關於金銀花、山銀花藥典標準分列問題”,張偉表示,在2014年3月,藥材和飲片專業委員會、中成藥專業委員會分別就這個問題進行過審議,並形成了專家意見:基於目前中藥學科發展和研究現狀,綜合分析金銀花和山銀花這兩者在本草考證、植物形態、藥用歷史、化學成份和安全風險等方面存在的差異,在新版藥典2015版藥典中繼續將金銀花、山銀花分列收載,並建議進一步加強山銀花基礎研究,為今後山銀花的臨床應用提供依據。關於山銀花、金銀花的功效問題,由於山銀花的臨床應用歷史比較短,文獻中缺乏有關性味歸經功能主治的相關收載,在當年收載藥典時以金銀花的功能主治進行概括的,目前沒有新的臨床研究工作,缺乏一些相關的資料。所以建議2015版藥典中,山銀花的功能主治仍沿用金銀花的功能主治表述。
對於處方中金銀花變成為山銀花更需要尊重原研,原來用的是金銀花,還應該使用金銀花。另外,要以企業自願申請為主,而且要提供相關證明,要按程序來進行。處方變更中應當防止損害公眾利益和公共知情權,就是表明山銀花也好,還是金銀花也好,必須要在處方上進行明確的標識。同時也要盡量防止產生新的同名異方。

更多精彩內容
關註第一財經網微信號
Next Page