照這思路改,藥企得過幾年苦日子 唯心所現
http://xueqiu.com/9585384906/38037786這是醫療領域的打土豪分田地,革你的命,還要分你的錢給醫院和患者,建立醫改新格局。 上升到總理的話,那就是「藥價降下來,醫療要上去,醫保要保住」。藥改是醫改的第一紅利。
雷霆萬鈞打土豪,醫改未來藥企慘淡藥品招標信息網 飛鳥
儘管網上通知很少,但安徽各地已經很低調地用實際行動將帶量採購快速開展起來。據悉,安徽將在4月1日前執行帶量採購結果,其進展之迅速,勢如雷霆萬鈞。各位小夥伴,你可準備好了?
1、透過迷霧:安徽為什麼要帶量採購?按《安徽省深化醫藥衛生體制綜合改革試點方案》精神,安徽將以「轉變機制」為核心,牢牢把握「
患者就醫負擔不增加、醫務人員收入不減少」兩個原則,認真做好「取消藥品加成、調整醫療技術服務價格、推行藥品聯合帶量採購等」三個同步,以藥品零差率銷售為突破口,全面開展藥品和耗材帶量採購工作。
所以,你看明白沒?要在上面兩個原則下完成醫改。俗話說,國家醫保負擔這麼重,老百姓看病這麼難這麼貴,醫生那麼黑(抱歉這麼引用),改革要首先從哪兒下刀?砍醫生?醫生給撂挑子了怎麼辦,衛生事業誰挑擔子幹活兒?想在保障醫生和醫院積極性的前提下完成醫改,那就得先從藥企下刀。
這些天,大家都在抱怨「醫改」為何變為「藥改」。那筆者告訴你,藥改是醫改的紅利來源和第一驅動力。只有把藥價砍到死,沒錢給醫生回扣,這樣才能減輕醫保支出和負擔,實現藥佔比降低15%的目標。只有財政富裕了,才能有充足的錢來補貼醫院,提高診療費用和醫生待遇。降低藥價,提升診療,這是國家期望的改革目標。上升到總理的話,那就是「藥價降下來,醫療要上去,醫保要保住」。
但實現醫改轉型,帶量採購就是個「很實際」但也很猥瑣的做法。一方面利用醫院天然的壟斷力,通過帶量採購、議價談判來降低藥價,一方面用藥企降價讓利的錢在醫改轉型期去養醫院和醫生,以減少政府財政開支,降低醫保負擔。最終徹底扭轉藥品費用和診療費用的天平,藥價降低,老百姓費用不增加,醫生收入不減少,讓代理商沒空間給回扣,讓醫生安心做醫療,何樂不為之?
所以說,這是醫療領域的打土豪分田地,革你的命,還要分你的錢給醫院和患者,建立醫改新格局;這是新時期醫改工作中黨的統一戰線、密切聯繫群眾、科學發展觀的智慧結晶。
2、眺眼未來:安徽醫改是什麼新格局?
1) 取消藥品加成,全面零差率從4月1日起,安徽將取消公立醫院15%的藥品加成,全面實行零差率,相當於給老百姓降價讓利15%。
2) 向企業和商業議價,平均降價15%-20%通過此次公立醫院帶量採購,要平均降低藥品價格15%-20%。初步判斷銷量前30-50的產品單獨向生產企業議價,其他產品打包向商業議價。前30-50的國產藥要求80扣,進口90扣,不帶量打包向商業議價的品種也要求80扣,可謂無論是否「量大」都要降價。儘管可能分質量層次,但在醫保支付改革的利益驅動下,唯低價者成交的可能性更大,最終將實現藥品耗材收入佔比降低到40%以下的目標。
3) 降低醫用設備檢查價格10%省屬醫院CT、磁共振、超聲檢查價格在現行基礎上降低10%。如磁共振平掃每部位由390元降為351元,單次多層CT平掃每部位由200元降為180元。
4) 提高醫療服務價格提高長期偏低手術、治療、護理及部分中醫服務類價格。根據技術含量和複雜程度,省屬醫院治療價格提高20%,一、二類手術價格提高35%,三、四類手術價格提高50%。如四類手術異體腎臟移植術每次由1200元提到1800元。同時,完善診察費項目價格。診察費設西醫診察費和中醫辨證論治,掛號費、病歷納入診察費。城市公立醫院設立普通、專家和知名專家門診診察費。省屬醫院普通、專家和知名專家西醫門診診察費分別為10元、20元和50元。中醫辨證論治相應上浮3元。
實行分級定價,二級醫院和三級醫院醫療服務價格應保持10%-20%的差價。市、縣屬公立醫療機構的醫療服務價格下放到市級管理,具體價格不得高於省級公立醫院同類價格水平。
5) 病人的負擔不加重,醫保蛋糕重新分割經調查,取消藥品加成,調整醫療服務價格後,省立醫院門診次均費用由每次279.8元降到273.1元,住院次均費用由16074元降到16008元,達到患者負擔不增加的目的。(其實在本鳥看來,患者享受的診療費用降低才幾塊錢到幾十塊,與醫院帶量採購二次議價的偉大成果相比,真是毛毛雨了。)
為方便患者,繼續保留便民門診,對單純購藥及慢性病病人定期檢查等不需提供新的治療方案的,每次診察費為1元。為不增加患者負擔,調整後的醫療服務價格按規定納入醫保報銷範圍。對精神類、傳染類等專科醫院,取消藥品加成後,同級財政部門適當增加補助,以保障正常運轉。
在上述改革目標實現後,我們將會看到:
■ 零差率讓利百姓,二次議價向廠家索紅利,以藥補醫隱形化;
■ 藥品招標演變為省級技術標和限價,地市商務標帶量採購的新型雙信封形式。
■ 醫護人員有望告別「灰色收入」,靠「獎金」和「手藝」吃飯;
■ 藥價大幅壓低,少降價意味著出局;
■ 代理商生存空間縮緊,四大批發商圈地控盤;
■ 打土豪建新局,對某些藥企來說醫改紅利時代徹底終結;
■ 大部分藥品的生命週期急劇縮短,結局慘淡。本鳥認為,安徽只是個現狀的典型代表。面對慘淡的結局,我們能說什麼呢?
有人問:
「一顆藥品成本只有50美分,為什麼要賣500美元?」
「因為那是第二顆,第一顆的成本是50億美元」
$海正藥業(SH600267)$ $恆瑞醫藥(SH600276)$ $紅日藥業(SZ300026)$ $康緣藥業(SH600557)$ $益佰製藥(SH600594)$ $以嶺藥業(SZ002603)$ $信立泰(SZ002294)$ $康恩貝(SH600572)$ $譽衡藥業(SZ002437)$ $爾康製藥(SZ300267)$$上海凱寶(SZ300039)$ $天士力(SH600535)$ $雙鷺藥業(SZ002038)$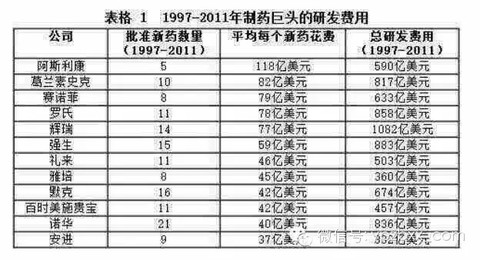
县级公立医院改革对药企的5点影响 医药云端信息
http://xueqiu.com/5867983716/43311395
公立医院改革是医改的重中之重,其中,县级公立医院则是连接城市和乡村医疗机构的重要环节。2012年县级公立医院综合改革试点启动以来,共有两批1011个县(市)进行试点,在此基础上,2015年将全面深化县级公立医院改革。
今天,国务院办公厅下发《关于全面推开县级公立医院综合改革的实施意见(国办发〔2015〕33号)》(以下简称33号文),对县级公立医院做出了总体要求和确定改革目标。其中,对于医药行业具有影响的内容如下:
1.降低药品耗材的费用将用于提升医疗服务价格33号文最值得关注的一点不在药品政策而在于医疗服务价格的调整。文件规定:
在保证医保基金可承受、总体上群众负担不增加的前提下,将通过推进药品和耗材招标采购、流通、使用等方面改革降低的费用,主要用于调整医疗服务价格,不得直接返还医院。
这句话包含了几层意思:1)医疗服务价格会调整,会提升;2)通过药品、耗材招标、流通、使用等方面改革降低费用来提升医疗服务价格,再一次提醒诸位药价是必降无疑的;3)开支增长是有条件的:保证医保基金可承受、群众负担不增加。
但这还不是本文的最大亮点,亮点在于降低药品耗材价格,以什么方式降低?降低后的费用用于调整医疗服务价格,那么是否意味着存在二次议价的可能性?因为我们知道,如果单纯的招标降价,降价部分随着价格降低「蒸发」,不会带入后续采购,除非存在招标后的第二次定价,才有可能产生第一次定价(招标)和第二次定价(二次议价)之间的差额。
当然,这仅仅是点苍鹤的猜测,但有一点是肯定的,33号文强化医保资金的收支预算管理,将逐步在县级公立医院实施医保总额预付制,先核定医保的总盘子,再在这个盘子里划分药品和医疗服务价格的支出,医疗服务价格上升和药品价格下降同步进行。
其次,降低部分不直接返还医院,那么最后究竟以什么方式补偿医院呢?
安徽的带量采购,以省级中标价=医保支付参考价≥实际采购价的方式,将实际采购价与省级中标价之间的差额通过医保支付方式返还给医院;绍兴的做法与此类似,区别在于差额部分通过财政拨付的方式返还给医院;
三明第一批14个品种的医保支付方式,则是按照同通用名同剂型同规格的药品中选择价格最低的那个仿制药作为医保支付价,超出支付价部分的基本医保统筹资金不予支付,其实,差额部分在支付价的设定时被医保基金中心直接「截留」了。
33号文对于差额部分不直接返还医院的规定,有意无意透露了国家不会采取安徽的做法,而是很有可能采取三明的方式在县级公立医院改革中推行。如果是这样的话,又有新的联想:医保三保合一归属权估计快尘埃落定了!
2.调整医疗服务价格间接增加药品价格管理的压力
33号文明确将医疗服务价格调整权限下放到县(市),这一政策甚至比起安徽医改方案中将此下放到市一级管理更加大胆、步子迈得更大。调整原则按照「总量控制、结构调整、有升有降、逐步到位」,建立以成本和收入结构变化为基础的价格动态调整机制。价格调整政策与医保支付政策相互衔接。
医疗服务收入是医院除了药品耗材外的另一重要收入来源,长期以来的低位运行不仅没有体现医务工作者的劳动价值,反而逼着医院只能通过卖药来维持日常运营。提升医疗服务价格总体来说是件好事,但从药企角度来看,在医院收入总盘子不变的前提下,服务收入上去了,药品耗材收入肯定会下来。而医疗服务价格权限下放到县(市),再加上其价格调整将与医保支付政策相互衔接,在点苍鹤看来,价格管理其实变得更为复杂。此长彼消,会间接带来对药品耗材价格、使用、医保支付等相关政策的不稳定因素。药企必须关注。
3.利好国产创新药和医用耗材,
辅助性、高回扣的药品、抗菌药物和高值医用耗材利空
在药品供应及使用政策上,33文要求全面落实7号文的各项精神,并在此基础上鼓励在质优价廉的前提下购买国产创新药和医用耗材,这对于国产药品来说无疑是个利好。但请注意,这是国产创新药,不是专利药品仍然没有竞争优势。
对于辅助性、高回扣的药品和高值医用耗材来说要注意了,33号文要求将重点围绕以上产品,加强对医务人员处方行为的监控,推行电子处方,按照规范建立系统化、标准化和持续改进的处方点评制度,促进合理用药。各省对于县级公立医院普遍要求基药使用占比在40%-50%,再加上低价药部分,这个比例将在50%以上,这意味着非基药的县级医院市场进一步被压缩,而其中的辅助性、高回扣(高空间?)品种更是危险了。
不仅如此,33文继续重申了医院使用各类药物特别是抗生素的监管,对抗菌药物用药量靠前的品规及处方医生进行公示,运用处方负面清单、处方点评等形式控制抗菌药物不合理使用。严格控制高值医用耗材的不合理使用,加大回溯检查力度,及时查处为追求经济利益的不合理用药、用材和检查检验等行为。
4.强化医保基金收支预算和临床路径管理
2015年底前,医保支付方式改革要覆盖县域内所有公立医院,覆盖30%以上的县级公立医院出院病例数。到2017年,全面实行以按病种付费为主,按人头付费、按床日付费等复合型付费方式。加强临床路径管理,各省(区、市)要根据县级公立医院功能定位和实际技术能力等,明确诊疗病种范围,建立适宜的临床路径、处方集和诊疗规范,规范处方行为,控制过度检查、过度治疗。
除了医保目录的品种管理之外,33号文甚至把药品使用管理延伸到了非医保品种以外,如:
加强对基本医保目录外药品使用率、药占比、次均费用、参保人员负担水平、住院率、平均住院日、复诊率、人次人头比、转诊转院率、手术和择期手术率等指标的监控。
5.鼓励患者自主到医院外购药
33号文鼓励患者自主选择在医院门诊药房或凭处方到零售药店购药,采取多种形式推进医药分开。国务院在喊话了,医院要手下留情放开患者,给予其拿药权。这是一个积极的信号,但从目前情况看,在没有完全理顺医疗机构各项改革之时,医院仍然没有处方外流的动力。
外資藥企爭奪國內OTC市場 輝瑞斥資9500萬美元擴大在華產能
來源: http://www.yicai.com/news/2015/06/4633288.html
外資藥企爭奪國內OTC市場 輝瑞斥資9500萬美元擴大在華產能
第一財經日報 王悅 2015-06-17 06:00:00
“輝瑞健康藥物部在過去六年的增速均為雙位數,其中主力品牌就是鈣爾奇和善存。此次新建的蘇州工廠將主要用於布局輝瑞的健康業務,滿足不斷增長的國內外市場需求。”
“輝瑞健康藥物部在過去六年的增速均為雙位數,其中主力品牌就是鈣爾奇和善存。此次新建的蘇州工廠將主要用於布局輝瑞的健康業務,滿足不斷增長的國內外市場需求。”輝瑞健康藥物部大中華區總經理蔡寶光對《第一財經日報》記者表示。
6月15日,輝瑞宣布在蘇州投資9500萬美元的新廠正式破土動工,預計2018年一季度投入商業化生產。輝瑞方面透露,該新廠區將主要生產鈣爾奇、善存系列健康藥物產品,建成後預計銷售額20億元人民幣/年,公司總銷售額將超50億元人民幣/年。
“目前在中國,善存的用戶超過890萬,鈣爾奇覆蓋人數超過1370萬。在2014年,中國已經成為輝瑞全球健康藥物部排名第一的海外市場。”蔡寶光表示。
據了解,目前輝瑞在國內共有四個生產基地,1989年投產的大連基地主產心血管、抗感染藥物以及萬艾可。無錫工廠以生產腫瘤藥物為主。前幾年與國內藥企海正藥業合資的海正輝瑞則主產腫瘤和抗生素。而在1994年正式投產的蘇州輝瑞工廠此前主產鈣補充劑、多種維生素、抗感冒咳嗽藥、抗生素等多種處方藥和非處方藥。此次新建的蘇州新廠為輝瑞在國內的第四個基地。
不過值得註意的是,在今年1月19日,江蘇省食藥監曾發布《關於同意註銷輝瑞蘇州制藥有限公司藥品生產許可證的批複》(蘇食藥監藥生〔2015〕9號)的通知,同意註銷輝瑞蘇州制藥有限公司藥品生產許可證,證號為:蘇Hb20060158。
市場傳言,該藥品生產許可註銷為輝瑞的主動行為,放棄產品不占優勢的蘇州生產基地。
而在此次發布會上,輝瑞方面則透露,此前的輝瑞蘇州工廠主要生產產品為非處方藥物,破除了放棄蘇州基地的傳言,表明輝瑞僅放棄蘇州基地處方藥生產,轉戰OTC。此次新廠是繼續加碼,據悉,新基地還將設置輝瑞健康藥物部亞太區研發中心。
在新的藥品招標政策下,藥價下行,如今的中國藥品市場已遠不如前幾年賺得輕松。在今年1月28日,湖南藥品招標,對範圍內的26440個品規進行了少則10%、多則50%的價格下壓,大幅度下壓使得外資藥企紛紛棄標。
另一方面,處方藥專利到期潮的來臨,也讓在華藥企的利潤空間進一步壓縮。以此前輝瑞的明星產品——男性用藥“萬艾可”(俗稱“偉哥”)為例,自在中國的專利保護去年5月到期以來,國內十多家藥企已開啟“搶灘”,白雲山(600332.SH)版仿制藥“金戈”目前已成為國內首家審批完畢的國產“萬艾可”,市場預計國內版“萬艾可”將會比輝瑞版便宜六成多,競爭加劇。
處方藥市場動蕩不安,同時,中國人口優勢以及老齡化的來臨又讓外資藥企無法放棄這一仍處於成長中的巨量市場。OTC市場爭奪成為了必然趨勢。
“從1992年至今,輝瑞中國健康藥物部的銷售額從小於100萬美元上升到了去年的大於3億美元,中國現在是輝瑞健康藥物全球最大的市場,也是增長最快的市場。”輝瑞健康藥物部亞太、歐洲、中東及非洲地區總裁AndySchmeltz對記者表示。
事實上,布局中國OTC市場的絕不僅輝瑞一家。
.jpg)
去年11月3日,拜耳和滇虹藥業同時各自發布公告,公告宣布拜耳已完成對滇虹藥業所有股份的收購,收購價格為36億元。而對於此舉,拜耳方面表示,此次收購將有助於拜耳在華OTC業務的發展。
“中國保健品市場達到10%的增長,如果從中國的GDP來講,健康產業高於GDP的增長。現在中國的老百姓更註重自己的健康,老齡化的情況在中國也很普遍,這也是為什麽健康產業有比較好的增長。”蔡寶光對《第一財經日報》記者表示。
在銷售戰略上,輝瑞方面表示將會通過與醫院、零售藥店合作以及電商渠道來進一步拓展健康藥物在中國的銷售。
“在健康藥物這塊,目前在中國我們是以善存、鈣爾奇、惠菲寧等為主打品牌。由於任何一個新的產品引入中國都要經過非常嚴格的監管審批,我們會非常積極努力地考慮如何把其他新的產品帶入到中國,一旦我們獲得了這種註冊審批的批準,我們肯定願意把一些新的品牌帶入中國。”AndySchmeltz對記者表示。
編輯:一財小編

更多精彩內容
關註第一財經網微信號
曝藥企從牛雜店進貨 註射液成品流向全國
0
來源: http://www.nbd.com.cn/articles/2015-07-17/930969.html
國內幾十家藥企和保健品企業卷入不合格銀杏葉的風波尚未停歇,武漢華龍生物制藥有限公司又被驚爆從牛雜店購買中間產品,並制成小牛血去蛋白提取物註射液流向市場。
一波未平一波又起。
國內幾十家藥企和保健品企業卷入不合格銀杏葉的風波尚未停歇,武漢華龍生物制藥有限公司(以下簡稱“武漢華龍”)又被驚爆從牛雜店購買中間產品,並制成小牛血去蛋白提取物註射液流向市場。
據《中國經營報》記者了解,盡管藥企內部和各地方政府都自設質量監管部門,但武漢華龍的違法行為卻是在國家食品藥品監督管理總局飛行檢查(以下簡稱“飛檢”)中被查處的。業界人士質疑,在國家監管部門人力精力有限的現狀下,這是行業內的潛規則,還是個別企業不巧撞上了槍口?
今年6月17日,國家食品藥品監督管理總局發布《關於武漢華龍生物制藥有限公司違法生產小牛血去蛋白提取物註射液的通告》(2015年第21號,以下簡稱《通告》),通報了武漢華龍的違法生產行為,責令該企業全面停產整頓,並收回其《藥品GMP證書》。
飛行檢查是食品藥品監管部門針對藥企開展的不預先告知的監督檢查,具有突擊性、獨立性、高效性等特點。
據不完全統計,今年以來,截止7月份,逾60家藥企被收回GMP證書,數目超過往年。行業人士認為,從植物提取物到動物提取物接連被整肅,飛檢顯著頻繁,或成為常態化的監管方式。
牛雜店的秘密
武漢華龍是湖北省龍頭企業廣信科教集團旗下全資子公司,有十多年歷史,於2014年2月獲得了新版GMP認證證書。
記者在武漢華龍官方網站上的公司簡介中看到,武漢華龍還獲得“國家級火炬計劃項目”承擔單位、“生物生化藥品全國三強單位”等一系列國家級別的榮譽稱號。
而這與目前被查處的罪狀形成戲劇化的對照,制藥的中間產品不是來自藥廠的生產線,而是來自沈陽市於洪區順濤牛雜經銷處。
據介紹,小牛血去蛋白提取物註射液是神經內科用藥,用於改善腦功能。根據批準的小牛血去蛋白提取物生產工藝,企業應當在經藥品GMP認證的本企業生產車間內,使用新鮮小牛血或小牛血清為原料,經過醇沈、離心、濃縮後制成小牛血濃縮液,再經過超濾或透析、灌裝等步驟制成小牛血去蛋白提取物註射液。
而業界人士表示,國家對生化藥品企業生產的要求是連續生產,也就是說整個生產過程不能停頓。所采用的原材料需要從規定的合法渠道購買,具有國家註冊批準工藝和達到藥用標準,用於提取制藥產品的動物也會有品種、年齡、飼料等相關質量條件,來控制藥品的安全性。而華龍生物的中間產品卻是從沒有這方面資質的牛雜店購入,令人大跌眼鏡。
此外,相關部門在對位於沈陽市的牛雜經銷商進行延伸檢查時發現,生產小牛血濃縮液的環境惡劣,完全不符合藥品生產的基本要求。這也就意味著,藥廠若使用該濃縮液生產的小牛血去蛋白提取物註射液則無法保證藥品質量。
國家食品藥品監督管理總局藥品化妝品監管司司長李國慶則對外表示,武漢華龍相關產品的生產記錄系全部偽造,中間產品是從牛雜店經銷商處購得,卻記錄為自己生產。
李國慶表示,生化藥品的來源是動物,其危險因素比化學藥品、植物藥品多很多,藥品管理法、藥品GMP對此都有明確要求。
根據武漢華龍官網上的公告顯示,截至6月13日,共召回2014年1月至2015年5月8日生產批號的221902支,而實際生產總量則為3981491支。而其召回臺賬顯示,其小牛血去蛋白提取物註射液產品幾乎覆蓋全國,絕大多數地區顯示產品“實召回數量”為0,意味著已經被使用。
針對總局對湖北省食藥監局督促武漢華龍立即召回全部市售小牛血去蛋白提取物註射液,並確保在6約20日之前召回到位和監督銷毀的要求,記者致電詢問相關進展,湖北省食藥監局新聞處相關負責人表示,以官網公布信息為準,並且強調是國家食藥監總局展開的“飛行檢查”查處了武漢華龍,所以相關問題應向國家食藥監總局方面咨詢。
本報記者致電武漢華龍,兩部總機均無人接聽,在撥通了銷售熱線的電話之後,銷售人士表示,公司目前還處在停產整頓的狀態,所以沒人上班。在記者詢問相關問題的時候,對方又以“最近武漢天氣很熱,公司在放假,無法找到相關領導接受采訪”為由拒絕了記者的采訪。
監管缺位
國家食藥監總局7月8日發布了《藥品醫療器械飛行檢查辦法》,將飛檢由原先僅針對生產環節,擴大至研發、經營和使用環節,並明確飛檢過程中與公安機關的銜接機制。
一位不願具名的資深業界人士對本報記者表示,出於地方保護主義,某些地方上的食藥監局會對違法違規行為睜一只眼閉一只眼,這才導致國家食藥監總局到各地飛檢時才直接查處到不法行為。
除地方保護盛行而導致的監管缺位之外,企業自身也難辭其咎。浙江海正制藥業有限公司質量法規總監李永康告訴記者,制藥企業內部都會自設質量監管部門(QA,即質量保證部),但是這種設立也很難有效地保證藥品質量。
由於到目前為止,小牛血去蛋白提取物註射液的不良反應報告還未出現明顯異常,也沒有爆出消費者因此而出現不良反應的案例,所以武漢華龍只是處於停產整頓中,沒有受到更進一步的嚴懲。
不願具名的資深醫藥人士對記者表示,雖然國家監管力度在加強,但是制藥行業類似的違反法律法規行為一般都不會受到直接的經濟處罰,雖然停產會使制藥企業造成經濟重創,但同樣的事情發生在歐美,企業面臨的後果會嚴重得多,相關部門開出巨額罰單是一方面,更有可能直接關停企業。“國內一般都是收回《藥品GMP證書》幾個月,企業內部所謂的整頓自查完了,如果沒有出現導致消費者致命、致殘等重大事故,基本也就不了了之。”
本報記者在湖北省食藥監局官網瀏覽發現,以今年5月份由該局收回幾家藥品生產企業的GMP證書事件為例,根據後續的公告顯示,有的僅過半個月就發還,最遲也就一個月左右。
2014年11月,修正藥業集團也在一次國家食藥監局的飛檢中“栽了”,被查出原料庫存放的藥材還魂草出現發黴和變質,此外還被發現故意編造虛假檢驗報告等行為,也被收回了《藥品GMP證書》,記者至今沒有在吉林省食藥監局的官網上查到發還證書的公告。
可見,在制藥產業鏈的上遊環節,存在著大量問題。業內人士告訴本報記者,尤其在生物制藥的原料提取這塊,市場較為混亂,一方面是正規渠道少,原材料不足,另一方面也是出於降低成本的考慮。
此外,國家在這一領域的監管較為疏漏,並且大多數監管人員並非食品藥品行業的專業人員。對比之下,FDA(美國食品藥物管理局)的監察員則是由醫生、律師、微生物學家、藥理學家、化學家和統計學家等專業人士組成,他們均需要經受包括計算機技術等等在內的特殊訓練,外界評價“他們眼光敏銳,像福爾摩斯一樣”。
浙江海正制藥業有限公司質量法規總監李永康介紹,FDA正在改變對制藥行業進行監管的方法,以保證行業內的各家公司能更好地遵守GMP。該機構通過實施“仿制藥用戶收費法”(GDUFA),要求公司在提交生產設施、藥物申請和藥物主文件(DMF)申請的時候繳納一筆強制性的費用,FDA就可以使用這筆收入來雇傭和培訓增加的監察人員。未來,FDA還會根據制藥商對於GMP的遵守信息進行打分(稱為質量度量),根據分數來決定企業被檢查的頻率。
武漢華龍無法召回的那些註射液產品,流向的終點是患者。無論是資深業內人士,還是醫療糾紛領域的律師,都對記者表示,國內藥企的違法成本太低,消費者想要維權也是難上加難。這也是緣何藥企違規違法行為屢禁不絕的原因。
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
每經網客戶端推薦下載


每經網首頁
8家藥企數據涉假 華海、康芝回應在查
來源: http://www.infzm.com/content/113019

(新華社/圖)
近日,國內制藥業又被爆出“數據涉假”事件。
11月11日,國家食藥總局發布公告稱,在對部分藥品註冊申請進行現場核查時,發現8家企業11個藥品註冊申請的臨床試驗數據存在擅自修改、瞞報數據以及數據不可溯源等涉嫌弄虛作假問題,決定對其註冊申請不予批準。
此次設想造假的企業包括華海藥業、康芝藥業兩家上市公司。
對此,據每日經濟新聞消息,華海藥業回應稱,針對此次國家藥監局核查中的問題,華海藥業表示正與委托機構全面了解核實並查找原因。
據了解,坎地沙坦酯片主要用於治療原發性高血壓,截至目前,該藥品已累計投入研發費用約450萬元。
據近期華海藥業公布2015年三季報,公司前三季度凈利潤同比大增68.14%。而增長的主要原因在於公司原料藥業務生產銷售穩定增長,特別是沙坦類產品和神經類產品銷售大幅增長。
康芝藥業相關人士則表示:“公司獲悉國家食品藥品監督管理總局2015年第229號公告中,涉及我司消旋卡多曲幹混懸劑委托藥物臨床試驗機構進行臨床試驗研究之試驗數據問題,公司高度重視,本著認真負責的精神,將盡快查清事實。”
數據造假,誰該擔責?
值得註意的是,在此次核查結果公布之前,國家食藥監總局曾給過企業“自首”機會。
7月22日,食藥監總局發布《關於開展藥物臨床試驗數據自查核查工作的公告》。公告提到,若申請人自查發現臨床試驗數據存在不真實、不完整等問題的,可以在2015年8月25日前提出撤回註冊申請。
據第一財經日報消息,“史上最嚴的數據核查令”頒布後,1622個品種的註冊申請中有20%要求主動撤回,被業內人士認為是“造假心虛”之舉。按照上述文件規定,一旦本次責任認定明確,未來3年內涉事公司申報的品種都不會被受理。
與此同時,受到影響還包括相關臨床醫院和CRO,相關醫院可能會吊銷臨床試驗中心資格,涉事CRO或將面臨整改。根據意見,弄虛作假的直接責任人參與研究或組織(即CRO)研究的臨床試驗資料十年內不予受理。
另據新京報消息,一位不願具名的制藥業內人士表示,很多藥品的臨床試驗,按原來的檢查標準可能會通過,這個公告出來後相對更加規範和嚴格,但一些企業和機構可能仍心存僥幸,認為查不到自己頭上。
中國醫藥企業管理協會副會長牛正乾則認為,當前國內藥企的藥品臨床試驗多是委托機構來做,“藥企在這方面並不專業,真正專業的是機構,而機構也是相關部門認證過具有資質的。”牛正乾認為,“在這種情況下,出了事不應由企業擔責。”
從食藥監總局官網公布的核查結果中看到,此次公布的藥品臨床試驗數據真實性存疑的8家企業,均是委托第三方機構進行臨床試驗。
仿制藥企站上註冊審批整肅風暴口
來源: http://www.yicai.com/news/2016/01/4742422.html
仿制藥企站上註冊審批整肅風暴口
一財網 王悅 2016-01-21 20:31:00
國家食品藥品監督管理總局宣布了128家企業撤回199個藥品註冊申請,包括恒瑞醫藥(600276.SH)、康緣藥業(600557.SH)、海正藥業(600267.SH)等多家醫藥上市公司赫然在列。
國家食藥監對仿制藥企的整肅從2015蔓延到了2016:1月20日晚間,國家食品藥品監督管理總局發布了今年的第一個撤布公告,宣布了128家企業撤回199個藥品註冊申請,包括恒瑞醫藥(600276.SH)、康緣藥業(600557.SH)、海正藥業(600267.SH)等多家醫藥上市公司赫然在列。
一場與藥品註冊審批相關的海嘯正在來臨,這一次,國內的仿制藥巨頭們站在了漩渦中心。
整肅緣由
同樣的生產工藝、化學配方,國產仿制藥的治療效果卻僅能原研藥的60%,這是國內不少患者寧願自掏腰包,也不願意購買能全額醫保報銷的仿制藥的最主要原因。
一位衛計委的內部人士如此總結我國的仿制藥低質量現狀:安全的仿制藥效果不顯著,療效好的仿制藥有著不可回避的副作用,總之就是無法達到原研藥的標準和療效。
患者最揪心的是藥品質量,對於企業來說,在這幾年最心煩的是藥物審評速度過慢而帶來的運營危機:09年以前申報的三類新藥(指在國外已有上市銷售,但國內暫未上市銷售的藥品)審批,平均批複速度大約在五到六年,但從2014年開始申報的三類新藥,平均的審批速度可能會超過十年,國外引進的新藥審批,速度也 幾乎相同之慢,最典型的例子是,葛蘭素史克生產的甲苯磺酸拉帕替尼從申請臨床到獲批上市,歷經102個月,花了幾乎九年時間。

仿制藥企站上註冊審批整肅風暴口(網絡資料圖)
不改革,帶來的直接後果就是老百姓不僅吃不上高質量、最新、最有效的治療藥物,藥企也會因為審批審評的速度停滯不前而嚴重影響企業的正常運轉。新藥審批持久戰讓不少藥企面臨在產品剛出廠房大門,就已經虧損的尷尬狀況。
企業連年抱怨,於是從去年下半年開始,針對解決這些問題的藥品審批審評改革如期而至,重頭戲是占積壓審評批件90%之多的化藥仿制藥。截至1月21日,國家食藥監公布的申請人主動撤回藥品申請合計達到了926個。
巨頭藥企迎來的是春天還是寒冬?
對於這場整肅風暴,業內表示出了不同的看法,一種方向的觀點認為,藥品的高要求會直接淘汰行業內實力不強的中小企業,畢竟不會有人拿著不合格的產品花費大量的經費和精力去申請,行業洗牌必定加劇,大企業還可以選擇並購有優質品種的中小藥企用以壯大自己的實力,“強者更強”。
另一種觀點則認為,新的審評標準對大企業的市場占有率並沒有幫助,反而會增加前期成本。在這個時候有的小企業反而會選擇沖一沖,或許可以搶到一些市場份額。
為此,《第一財經日報》記者前往采訪了居身此次風暴中心的國內仿制藥巨頭之一華海藥業(600521.sh),嘗試厘清企業的真實想法。
作為最先撤回藥品註冊申請的企業之一,去年11月30日,華海藥業發布一紙公告:宣布撤回包括米格列奈鈣片在內的八個註冊品種,涉及的研發費用約為3800萬元,成為了首批撤回註冊品種最多 的企業之一。在公告宣布的當天,公司股價應聲大跌,在3800萬元的研發投入之外,投資者更擔心的是政策對這樣一個剛著力開拓國內業務的企業後期生產和銷售的影響。
“短期內,品種撤回對公司有一定影響。”華海藥業副總經理、董事會秘書祝永華在接受《第一財經日報》記者專訪時表示,“在我們看來,此次品種撤回最主要的瓶頸還是出在了臨床環節。”
09年開始,一直布局海外原料藥、制劑生產的華海藥業將戰略重點轉向了國內,從那時起,華海開始在國內進行藥品的註冊申請。
“之前我們的戰略就是一地研發,三地申報。全球的藥品都是在國內完成生產,所以質量是完全一致的。事實上,目前華海在海外有16個已經上市的藥品文號,國內是八個。而這次撤回的八個品種,有七個我們已經在國外獲準上市銷售。所以我們才能肯定工藝本身沒有問題。”祝永華透露。
不僅僅是華海,包括在此次撤回事件中接連中標的A股巨頭恒瑞醫藥、海正藥業,也一直強調的都是“藥品本身並沒有問題”,但市場的恐慌依舊不可避免。那麽這場風波在他們眼里究竟是福是禍?
“以前我們美國、中國同時申請文號,美國的藥品已經批複下來生產銷售了,中國的還在排隊,我們相信改革之後這一情況未來會有改善。所以在我看來,盡管政策現 階段會對企業有影響,但是長遠看來是好事,提高審評標準,清理掉一批不合格的註冊申請後,審評的速度未來才可以加快。”祝永華表示。
祝永華告知記者,他並不擔心此前公司撤回的文號對公司長遠發展的影響,在最新的優先審評政策中,申請人在歐盟、美國同步申請並獲準開展藥物臨床試驗的新藥臨床試驗申請,或在中國境內用 同一生產線生產並在歐盟、美國同步申請上市且已通過其藥品審批機構現場檢查的藥品註冊申請可以優先審評,這對華海來說甚至是一大利好。
提速、洗牌,成為了巨頭藥企們對這次改革的最大期待。
據悉,此次食藥監為了提升審評速度,除了加強企業自查、提升一致性評價的要求外,對參與審評的價格也一再提升。
此前,國內做一次藥物審評的收費大約 在幾萬到十幾萬人民幣左右,門檻極低,導致企業不管藥物質量好壞,就“先申請了再說”,從而間接導致了審評件的積壓。而在今年,有藥企負責人告知記者,這 一價格已經提升數倍,普遍價格達到了40到50萬人民幣。值得註意的是,在美國,做一次仿制藥生物等效試驗的收費大約在40-50萬美元(約合360萬人 民幣左右)。門檻的提高將直接減少低質量藥物的申請數量。
並不缺錢的國內仿制藥企業對此次整肅的另一個對策是借機完成對中小企業的並購,擴大企業規模。據《第一財經日報》記者了解,目前已有不少仿制藥巨頭企業已經開始與外資藥企接觸,希望通過戰略合作的形式,借用外資藥企的口碑、技術,以及自身的生產制造能力進一步拓展市場。
“過去華海的短板是國內的文號、數量不多,對醫院的品牌影響力也有限,隨著國內醫藥政策環境的改善,註重藥品質量和創新的企業將迎來更大的發展空間,並購是我們正在考慮的發展路徑。”祝永華說,“海外發展的一只腿邁出去了,國內市場我們也希望能加快發展。”
編輯:彭海斌
發改委對五家藥企開出反壟斷罰單 10元藥品1年漲至50元
來源: http://www.yicai.com/news/2016/01/4745457.html
發改委對五家藥企開出反壟斷罰單 10元藥品1年漲至50元
央廣網 劉祎辰 2016-01-28 18:04:00
2015年,國家發改委放開了對除了精神類藥物、血液制品之外的大部分藥品的價格,把定價權交給市場主體。一時之間,不少人擔心藥價會合理上漲,而隨後的半年,一些藥物的確也是出現了漲價。
據中國之聲《新聞晚高峰》報道,2015年,國家發改委放開了對除了精神類藥物、血液制品之外的大部分藥品的價格,把定價權交給市場主體。一時之間,不少人擔心藥價會合理上漲,而隨後的半年,一些藥物的確也是出現了漲價。
但放開並不是放任,同樣是漲價,一些藥物的漲價是恢複性上漲,而有一些卻並不是。比如治療痛風的別嘌醇片,一年多漲了近4倍,其背後是生產廠家的蓄意串謀。今天上午,國家發改委向藥企開出了藥價放開以來的第一張反壟斷罰單,向抱團惡意漲價說不。
別嘌醇片,治療痛風的常用藥,至少對於我國八千多萬痛風患者來說,它可一點也不陌生。雖然全國獲得別嘌醇片批文的生產廠家有15家之多,但記者了解到,實際上2014年以來,市面上只有重慶青陽、上海信誼和江蘇世貿天階三家還在保持生產。而這三家藥廠,全部出現在了國家發改委今天公布處罰對象之列。經過查實,重慶青陽及其關聯銷售公司重慶大同、上海信誼聯合及其經銷企業商丘華傑、以及江蘇世貿天階共同協商,操縱了價格上漲。2014年4月,當事人經過協商,決定將當時售價為10元的別嘌醇片銷售價格提高到不低於18元/瓶;2014年12月,當事人協商並決定於2015年1月起提高到23.8元/瓶,而到了2015年4月22日,則決定在別嘌醇片被列入基本藥物的省份,銷售價格繼續維持不低於23.8元,而在被列為低價藥的省份,提高售價至不低於50元。
負責偵辦此案的國家發改委價格監督與反壟斷局調查二處副處長吳東美介紹,這些企業在協商價格時故意沒有形成書面協議,僅靠口頭約定,給偵查帶來了不少難度。調查人員將2013年以來的全部資料進行了查詢,一方面在同一家企業里,將工作筆記、工作計劃、總結互相認證;另一方面將不同的幾家公司間口頭協議的事實進行還原,並把銷售明細一筆筆進行比對。
除了約定價格,這三家全國僅有的別嘌醇片生產廠家,甚至還搞起了“三分天下”,分割銷售市場,例如約定重慶青陽一方負責四川、廣東、雲南等十二個省級區域,其余廠家的產品不許進入這個區域銷售,不能參加這個區域內的藥品采購招投標。反之它的產品也不能進入其它廠家的“勢力範圍”,消費者就只能被動接受這一個品牌。
按理說,三家企業一起生產這個藥品,彼此是競爭關系。那麽為何這三個藥廠卻表現得同氣連枝呢?這就要說到重慶青陽,它不僅是別嘌醇片僅有的三個廠商之一,更是別嘌醇唯一的原料生產商。反壟斷局調查二處王洋林這樣解釋說,重慶青陽對於其他的廠商來說是上遊企業,直接控制原材料,它和其他兩家共同生產別嘌醇片。根據調查人員提取到的證據,重慶青陽給另外兩家公司發通知,如果這兩家的藥賣到了重慶青陽的區域,對方必須原價回收,否則重慶青陽就斷供原料。
正是考慮到這一因素,因此在國家發改委對三家藥廠兩家經銷企業的處罰決定中,對於重慶青陽及其關聯企業重慶大同,處以年度銷售額8%的罰款,是所有企業中處罰比例最高的,其余企業的罰款比例均為上年銷售額的5%。據計算,此次處罰的五家企業被處以的罰款總計不到400萬元。如果僅以罰款金額來看,這算不上是一個反壟斷大案。但國家發改委價格監督檢查與反壟斷局局長張漢東表示,藥品是特殊的消費品,國家發改委今後對於藥品價格的違法行為查處力度還將不斷加大。
近年來,我國藥品的價格放開步伐不可謂不快,但放開的每一步,都伴隨著藥價一放就漲的傳聞,那麽究竟應該怎樣看待這一問題。國家發改委價格監督檢查與反壟斷局副局長盧延純明確表示,市場主體可以履行自己定價的權利,但是要在受到法律約束的前提下。過去大部分藥品是政府定價,現在是市場主體自己定價,但不是想怎麽定就怎麽定,要接受法律的約束。要保持合理利潤,價格上漲本身是可以理解的。但是這幾家企業的問題是互相商定價格,按照《反壟斷法》這是典型的橫向壟斷協議。
編輯:余佳瑩
中紀委官網:藥企出錢 北京平谷區衛計委官員三亞看樓盤
來源: http://www.yicai.com/news/5009616.html
據中紀委官方網站消息,北京市通報3起違反中央八項規定精神問題:
1.通州區交通支隊潞河大隊民警張超違規收禮問題。2015年2月,張超在處理通州區耿莊路口交通事故中,收受事故車主購物卡3張,共計人民幣3000元。經北京市公安局公安交通管理局局長辦公會研究,決定給予張超行政記過處分。
2.大興區青雲店鎮東趙村黨支部書記、村委會主任李海軍大辦婚喪喜慶問題。2015年5月,李海軍為其子舉辦婚宴,收受參加宴請的本村部分兩委班子成員及村民禮金人民幣5.69萬元。經青雲店鎮黨委研究,並報大興區紀委批準,決定給予李海軍黨內警告處分。
3.平谷區衛生和計劃生育委員會副主任張友接受旅遊招待問題。2015年4月,張友前往海南三亞看樓盤,期間機票、住宿、吃飯等費用由某藥品企業承擔。經平谷區紀委常委會研究,並報區委常委會批準,決定給予張友黨內警告處分。(北京市紀委)
中外藥企乙肝專利爭奪:最後十年數十億美元市場紅利
來源: http://www.yicai.com/news/5014717.html
對於全球的制藥企業來說,中國的乙肝藥物市場是最具吸引力的“肥肉”之一:我國慢性乙肝病毒攜帶者人數占全世界的34%左右。根據研究與咨詢公司GlobalData的數據,未來十年,中國仍將是最大的主要乙肝市場,市場規模預計將從2014年的近9.23億美元增長到2024年的逾14億美元。
但這十年,也極有可能成為目前已有的乙肝藥物在中國盈利的最後黃金十年。根據此前國家衛計委統計的數據,中國實施的以預防接種為主的綜合防控病毒性肝炎策略取得了顯著的效果,乙肝報告發病率呈下降趨勢,並有望此後逐年進入乙肝低流行國家。
種種環境交錯下,跨國藥企、國內仿制藥企比以往任何時候更看重這十年的市場爭奪,也正因此,一場有關乙肝藥物專利保護的爭奪戰拉開了序幕。
2016年4月26日,北京市高級人民法院做出1448號判決,駁回吉利德科學股份有限公司(Gilead Sciences)的上訴,認定其專利(中國專利號:200710196265.3)保護的含具體比例的替諾福韋二吡呋酯的富馬酸鹽專利無效。而這只是近幾年乙肝藥物專利爭奪的一個縮影。

國產仿制藥的步步緊逼
自上世紀90年代末期以來,包括葛蘭素史克、百時美施貴寶、諾華等跨國公司就紛紛將目光鎖定中國市場,進口肝病藥物隨即進入,並迅速占據了市場主導地位。
但近年來,隨著國產仿制藥的陸續審批、上市,跨國藥企被步步緊逼,盡管包括葛蘭素史克在內的進口乙肝藥物供應商屢屢降價,但國產仿制藥由於不再需要大量的研發投入,低廉的價格依舊分走了曾完全屬於進口乙肝藥物的一杯羹。
在國內的乙肝市場,江蘇企業正大天晴就是仿制藥中的佼佼者。在2014年,正大天晴靠著恩替卡韋等仿制藥品,實現了年銷售額100億元人民幣,其中恩替卡韋的銷售就占20%。正是正大天晴,讓銷售進口恩替卡韋的百時美施貴寶在近兩年的部分省市招標中應接不暇,節節敗退。
對於國內的仿制藥企業來說,這麽多年苦等的就是進口藥物專利到期的時間節點。“很多國外的藥物,只要他們在國外申請臨床了,我們就開始在國內同步研發、報審,然後專利到期了就在第一時間推向市場。如果等專利到期了再開始做就完全來不及。”正大天晴藥業集團股份有限公司副總裁田舟山此前對第一財經記者透露。
專利的陸續到期,讓國產仿制藥在近兩年的乙肝市場上風生水起,也正因此,中外藥企再次打起了“專利保護爭奪”的主意。

專利之戰未完
2016年4月26日,北京市高級人民法院做出1448號判決,駁回吉利德科學股份有限公司(Gilead Sciences)的上訴,認定其專利(中國專利號:200710196265.3)保護的含具體比例的替諾福韋二吡呋酯的富馬酸鹽專利無效。
抗病毒藥物替諾福韋的化學名全名為富馬酸替諾福韋二吡呋酯片,在中國,其適應癥之一為慢性乙型肝炎。
據了解,來自美國加州的吉利德科學,其產品替諾福韋在中國手握三項專利。分別是化合物專利(專利號:97197460.8)、化合物鹽專利(專利號: 98807435.4)和化合物鹽具體比例專利(專利號:200710196265.3)。而此次審判,僅針對最後一項專利做出無效判決,前兩項專利保護的糾葛仍有待解決。這也意味著,替諾福韋專利的官司在中國還沒打完。
而這也並不是近幾年唯一的一場有關乙肝藥物專利保護期的訴訟。
2010年,正大天晴首仿恩替卡韋,其後,百時美施貴寶對其仿制品發起侵權訴訟。但2015年,百時美施貴寶狀告正大天晴仿制其恩替卡韋被北京高院駁回,終審判決判百時美施貴寶的恩替卡韋專利在中國無效,正大天晴名正言順地繼續銷售。
另一家上海的仿制藥公司奧銳特,則瞄準了仿制替諾福韋。在2011年接受采訪時,奧銳特公司董事長彭誌恩稱此專利有重大缺陷,不屬於重大創新。彭誌恩希望,該專利在中國也能被取消。當年5月13日,奧銳特公司向國家知識產權局專利複審委員會提交了“替諾福韋專利無效申請”的相關證據,國家知識產權局受理。而當年4月,吉列德公司則以侵犯專利為由,已經將奧銳特公司告上法庭。雙方各不相讓。

緣何爭奪
根據中國疾病預防控制中心的統計數字,目前中國有約9000萬乙肝病毒攜帶者,其中有2800萬是慢性乙肝患者,760萬丙肝感染者。
根據世界衛生組織對乙型肝炎感染率的定義:超過8%的國家或地區被定義為高流行地區;乙型肝炎感染率小於2%的國家或地區被定義為低流行地區;而乙型肝炎感染率在2%~8%的國家或地區被定義為中流行地區。
1992年以前,我國屬於乙型肝炎高流行區,乙型肝炎表面抗原陽性率高達9.75%,每年因乙肝病毒感染相關疾病而死亡的人約有27萬人。
1992年我國衛生部將乙肝疫苗納入計劃免疫管理,對所有新生兒接種乙肝疫苗,但疫苗及其接種費用需由家長支付;2002年乙肝疫苗正式納入計劃免疫,對所有新生兒免費接種乙肝疫苗,但需支付接種費;2005年6月1日起全部免費。
疫苗接種對乙肝感染的抑制在數年後取得了顯著的效果。
2006年全國乙型肝炎血清學調查顯示,我國的乙肝病毒感染率下降至7.18%,15歲以下的兒童乙型肝炎的感染率明顯下降。2014年,我國再次對1~29歲人群進行了乙型肝炎血清流行病學調查。全國1~4歲兒童的乙肝表面抗原的流行率降到了0.32%,與2006年0.96%相比下降了66%,5~14歲的青少年乙肝表面抗原流行率降到了0.94%,與2006年相比下降了61%。
這就意味著,十年後這些兒童到了生育年齡,乙型肝炎的母嬰阻斷將不再成為乙型肝炎預防的主要問題。而且,只要堅持推廣乙型肝炎疫苗的接種,再過幾十年,我國就能夠成為乙型肝炎的低流行國家。
在這樣的乙肝市場判斷下,專利之爭就顯得尤為重要了:跨國藥企希望可以在專利保護期內實現更多的藥品價值,而國內的仿制藥企則希望可以更快地進入市場,在紅利消失前分得一杯羹。
讓藥企人士緊張的原因不僅僅來自於基於中國的乙肝患者未來會大幅縮減的判斷。複旦大學附屬中山醫院肝腫瘤內科主任張博恒告訴第一財經記者,目前市場上已有的治療乙肝的藥物並不能徹底治愈乙肝,需要“持續用藥”,但是一種可以徹底治愈乙肝的新藥已在臨床階段,“預計2~3年內就會走進市場。”而屆時,新老藥物的交替將進一步壓縮現有藥物的市場占有份額。
【人物】制藥“女神”杜瑩:做專註原創的中國初創藥企
來源: http://www.yicai.com/news/5016202.html
放棄了在美國12年優越的生活和成功的事業,杜瑩回憶起回國創業之初時期,她對《第一財經日報》戲稱“反倒感覺自己像一個外國人”。
讓她記憶最深刻的一次經歷是在一次商務會談期間,除了她之外,所有人都喝醉了。想到自己在事業高峰時期放棄了美國康涅狄格州安逸的生活,來和一群醉漢談判,杜瑩實在忍不住跑去外面大哭了一場。但當大家醒來時,他們二話不說就把合同簽了。

海歸歸來
2001年,當杜瑩帶著創建一家制藥公司的使命回到中國初期,她差點以為這是個錯誤的決定。從和記黃埔中國醫藥科技公司的首席科技官,到生物科技公司再鼎醫藥CEO,好幾次想放棄但最後還是堅持下來的杜瑩,其經歷代表了一大批致力於推動中國醫藥產業現代化和藥物創新的生物技術創業者。
對於最終選擇回國創業,杜瑩說:“中國是故鄉,而且這里發生了天翻地覆的變化,我在美國輝瑞工作多年後選擇回來發展,就是抱著要改變中國生物醫藥行業發展現狀的目標。”
但真正讓她選擇回國的一個重要原因,是她當時接到了大亨李嘉誠控股公司和記黃埔的電話,請她掌舵一家新的醫療公司和黃醫藥(HMPL)。對方的一句話“你在美國已經取得了那麽大的成就,為什麽不回國來做些事呢?”讓杜瑩開始萌生了回國的念頭。
在李嘉誠雄厚資本的支持下,杜瑩訪遍中國各地後發現,要成立一家公司並不簡單,因為相較於投資研發,國內醫藥產業對於做廉價的仿制藥更感興趣,這能讓他們賺取更多利潤。“大家想的最多的是如何交易和賺錢,他們對於挖掘隱藏的科學寶藏和創新不感興趣。”杜瑩當時感到非常失望,然而這也堅定了她要做一家專註於創新藥物研發企業的決心,“最大的挑戰是創新文化方面的不同,美國非常講究原創和多樣化,但是中國同質化競爭的跡象非常明顯。”
在她的牽頭下,和黃醫藥開始與禮來、阿斯利康等跨國藥企合作,逐漸形成了自主研發的能力。十年里公司成為了中國專註於生物醫藥領域創新藥物研發的領導企業之一,創造了很多“第一個”,比如第一個把自主研發藥物推向國際臨床三期試驗的;第一家與多家跨國公司達成合作協議的中國初創企業等。
2006年和黃醫藥在倫敦證交所成功上市。五年後,杜瑩選擇離開和黃醫藥,加入紅杉資本,負責其在華醫療投資業務。
“當時我想在風投機構能夠有更好的機會去支持和培養下一代中國生命科學的企業。”杜瑩表示,盡管自己在紅杉的時間非常短,但仍然感到很幸運,“我有幸領導了多項對中國最重要的醫療公司的投資,其中包括BetaPharma、百濟神州、JHL生物技術以及天使醫療等。
2013年,杜瑩再次選擇了離開,對於離開紅杉的原因,她告訴《第一財經日報》:“因為當時我就發現自己還是一個發自內心的創業者,依然非常熱切地渴望能夠建立自己的公司,並將它打造成為全球最偉大的生物科技公司,研發出最創新的藥物來服務於全球的患者。”
到這里,幾經輾轉、嘗試的海歸杜瑩,終於找到了自己回國後想要長久做下去的事業——創立再鼎醫藥。
女性領導力
如今再鼎醫藥在業界已經有較高的知名度和影響力,並從賽諾菲和百時美施貴寶等大型藥企獲得了一些還處於臨床試驗階段的藥物授權。但研發本土創新藥物,依然是杜瑩的長期目標。
今年初,再鼎醫藥從紅杉資本和其它投資機構募集到1億美元資金,並宣布將於近期在上海成立研發基地。杜瑩對《第一財經日報》說:“我的夢想是建立起一家立足於中國,服務於全球的領先生物醫藥公司,我們將引領全球創新、技術以及產品交付,並用我們的解決方案填補醫藥市場的缺口,使中國和全球的患者受益。”
為了這個夢想,杜瑩也付出了相應的代價。她說:“丈夫工作也非常忙,我還要照顧兩個孩子,小的那個今年才10歲,同時做一個母親和創業者真的非常難。我希望能有更多時間陪伴孩子,也希望讓孩子們看到自己為事業努力打拼,讓他們從小樹立心中的夢想並為之奮鬥。丈夫和孩子的理解和支持讓我在追夢的途中倍感寬慰。”
杜瑩的丈夫張亞飛,也是生物醫藥行業的知名人物。他目前負責一家德國的生物醫藥企業凱傑(Qiagen)的轉化醫學項目。在張亞飛的眼里,杜瑩既是一個成功的創業家,又是一個稱職的母親和妻子。“杜瑩是一個情商很高的人,善於與人交往,維護關系。而且她很清楚自己的目標,非常專註,不會為其它小事分心。”說起妻子,張亞飛眉飛色舞,他對《第一財經日報》記者說:“杜瑩非常堅定,能夠掌握大局,善於用人,求同存異。”
在杜瑩看來,成功的創業家所需要具備的品質包括富有遠見,影響力和洞察力以及學習的敏銳度。而對於女性創業者相比男性而言的優勢,她認為,“作為女人而言,我們更加具有關懷精神,也能更加務實地在複雜的環境中去推動與合作夥伴的關系。就像我們撫育自己的孩子一樣來培養我們的公司,但現實中高層女性領導人的比例要遠低於男性。”
再鼎醫藥的一個顯著特點是大多數員工都是“海歸”,其中9名高管全部在美國的大學深造過,這與杜瑩求賢若渴,大力引進海外歸國的科研人才的策略有密切關系。杜瑩表示:“隨著中國大量投入資源,尋求經濟轉型中的創新和高附加值,中國生命科學領域的機遇快速增加,這也將吸引更多海外優秀人才回國。”
在引進人才的同時,杜瑩還花很多精力去和國內的監管機構溝通討論,以獲得更多對於新藥研發的政策優惠,同時把中國的創新醫藥公司推向全球。她對《第一財經日報》說:“時代正在改變,我精心挑選了全球最優秀的人才和富有經驗的科學家納入公司,也經常和全球範圍內懂技術的監管層以及富有經驗的投資人交流,並努力讓中國創新醫藥企業獲得全球業界的認可。”
杜瑩認為,中國自主研發的原創創新藥確實不多,但可以看到國內的創新生態環境正在改善,政府也在大力支持、鼓勵企業創新。且伴隨著研究機構的質量提升以及商業投資環境的整體改善,創新企業擁有更多的機遇,能夠更加高效自主地運轉,這也將促成中國創新的繁榮。
對於再鼎醫藥的上市計劃,杜瑩表示:“我們制定了垂直整合的企業戰略,專註於創新藥物的發現、研究和商業化,同時希望通過樹立起這樣一家本土成長、具有全球影響力的公司。相信只要我們先專註於自己的本行,上市在將來就會是水到渠成的事情。”
Next Page

.jpg)
















