- 股票掌故
- 香港股票資訊
- 神州股票資訊
- 台股資訊
- 博客好文
- 文庫舊文
- 香港股票資訊
- 第一財經
- 微信公眾號
- Webb哥點將錄
- 港股專區
- 股海挪亞方舟
- 動漫遊戲音樂
- 好歌
- 動漫綜合
- RealBlog
- 測試
- 強國
- 潮流潮物 [Fashion board]
- 龍鳳大茶樓
- 文章保管庫
- 財經人物
- 智慧
- 世界之大,無奇不有
- 創業
- 股壇維基研發區
- 英文
- 財經書籍
- 期權期指輪天地
- 郊遊遠足
- 站務
- 飲食
- 國際經濟
- 上市公司新聞
- 美股專區
- 書藉及文章分享區
- 娛樂廣場
- 波馬風雲
- 政治民生區
- 財經專業機構
- 識飲色食
- 即市討論區
- 股票專業討論區
- 全球政治經濟社會區
- 建築
- I.T.
- 馬後砲膠區之圖表
- 打工仔
- 蘋果專欄
- 雨傘革命
- Louis 先生投資時事分享區
- 地產
Random Tags
爾康制藥:湖南證監局已派出核查小組進場核查
爾康制藥5月16日晚間公告,針對媒體報道,湖南證監局已派出核查小組進場核查,會計師事務所也正對相關內容進行核查,17日起繼續停牌。
此前,爾康制藥5月9日放量跌停,因自媒體發長文質疑爾康制藥涉嫌嚴重財務舞弊。公司股票已於5月10日開市起停牌。5月11日、5月15日公司分別發布《關於繼續停牌的公告》。
爾康制藥曾在2013年在柬埔寨布局過一個“年產18萬噸藥用木薯澱粉生產項目”。正是這個項目讓該公司如今陷入了輿論的旋渦。2016年,柬埔寨項目為該公司貢獻了超過6億元利潤,占了60.79%。質疑者稱,按照木薯澱粉的市場價格,上述項目不可能創造出如此豐厚的利潤。
5月11日,深交所下發對爾康制藥的關註函,就相關質疑表示關註,督促公司盡快進行核查,並請會計師出具相關說明,及時發布澄清公告。深交所將結合爾康制藥年報披露情況一並進行審核。
帥放文在5月12日的股東大會上回應表示,公司最近三年固定資產增長速度很快大部分都是從在建工程轉入的。但受限於信披規則,帥放文無法多說。為了證明固定資產的真實性,在股東大會現場,爾康制藥在現場播放了該公司在中國和柬埔寨10來個產業園區近8000畝占地,60萬平米建築的實景圖、衛星圖等。
【醫藥】特立獨行的山寨路:依靠仿制藥翻身做主人,印度制藥工業帶給中國的思考
來源: http://www.ikuyu.cn/indexinfo?type=1&id=12892&summary=
印度醫療服務產業,巨需求缺供給,空間巨大
印度醫療服務產業蘊藏著巨大的金礦
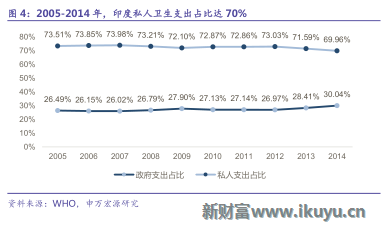
印度是世界第二人口大國,龐大的人口基數決定了印度醫療服務需求巨大,印度的醫療保障由公共籌資及私人籌資構成,由於政府財政投資較少,公立醫院供給不足,私人籌資及私營醫療服務機構在印度醫療服務體系中占有重要地位,據WHO數據,2014年衛生支出為920億美元,占GDP的比重從2000年的4.26%提升至2014年的4.69%,但從世界範圍來看,占比仍然較低;從衛生支出的構成來看,其中個人籌資占比30.04%,與之相對應的公共籌資占比僅69.96%。印度人口增長與老齡化,醫療基礎設施不完備,政府投入不足且財政壓力大,導致了印度醫療供需缺口的拉大。
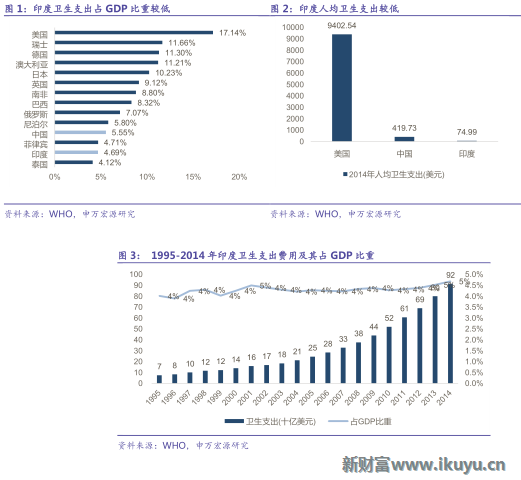
公立醫療服務投資不足,給予了印度非公立醫療服務領域巨大的潛力與想象空間。為解決供需矛盾,印度政府決定加大力度,全面放開鼓勵社會資本進入醫院產業,增加供給印度政府提供了一系列的優惠激勵政策,鼓勵社會資本進入醫院產業,極大地促進了印度醫院產業的私有化進程,私立醫院比例從印度建國初期的8%提升至78%。

阿波羅—印度最大的私立醫院連鎖集團
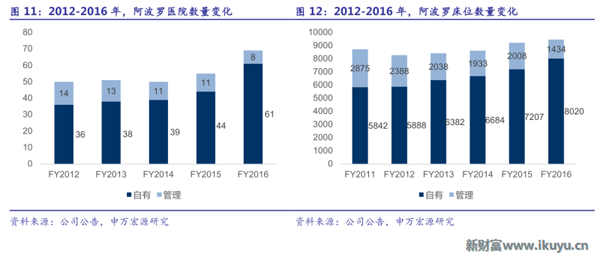
阿波羅醫療集團(Apollo Hospitals)是印度最大的私立醫院連鎖集團,始建於1983年,成立了印度第一家公司制的私立醫院。從1983到2016年間,阿波羅通過不斷的地域擴張和產業鏈延伸從一家擁有150張病床的私立醫院發展成為擁有69家醫院,日均入住4262名患者的綜合型大型醫療集團,業務範圍橫跨醫院產業、藥店、醫療保險等多個板塊。

阿波羅通過地域擴張不斷提升自身規模,從印度的一線大城市逐步向二三線城市擴張,市場份額進一步擴大,規模效應凸顯;同時,阿波羅通過產業鏈延伸,從醫院產業發展到連鎖藥店行業以及醫療保險行業,通過打通上下遊產業鏈,提升自身在醫療服務產業鏈各個環節的利潤獲取能力,打造集團統一品牌,充分發揮產業多元化的協同效應,鞏固霸主地位。2016財務年度公司實現收入609億盧比,2011-2016年收入CAGR達18%;2016財務年度實現利潤33億盧比,2011-2016年收入CAGR達13%,內生與外延雙輪驅動公司業績持續穩定增長。
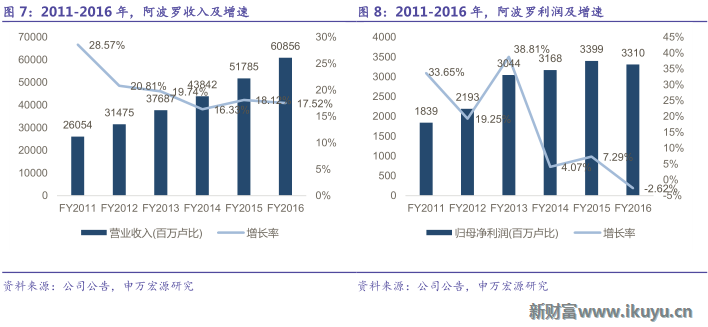
阿波羅業務橫跨醫院、藥店、保險等多個板塊,其中醫院及連鎖藥店是公司最主要的收入來源,據2016財務年度數據,醫院板塊收入占比60.07%,藥店板塊收入占比37.99%。
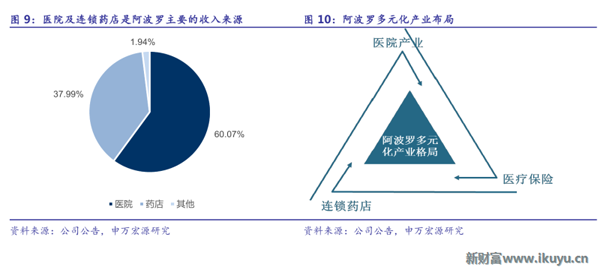
阿波羅的醫院業務規模穩步提升,醫院布局遍布印度各個地區,目前擁有醫院數量達69家,床位數近10000張,是名副其實的醫療航母集團。
他山之石,可以攻玉
對比印度,目前中國的醫療服務市場以公立醫院為主,非公立醫院仍處於發展初級階段,近年來我國大力推進公立醫院改革,鼓勵民營資本發展醫療服務事業,為上市公司介入醫療服務領域提供了新的機遇。對應A股,我們未來重點關註三條主線:1)醫院集團看好戰略清晰,具備卓越投資、並購及整合資源能力的上市公司,在集團化模式下依靠規模效應打造醫院產業航母;2)介入綜合性醫院領域具有獲取優質醫院標的資源及投後管理能力至關重要;3)專科醫院選擇規模大、高增長、高壁壘的專科領域,及連鎖複制及差異定位能力至關重要。建議關註標的:複星集團((600196)、愛爾眼科(300015))。
印度特色的仿制藥發展之路與未來創新突破
印度制藥產業升級模式,專利政策變化給予其發展機會
過去30多年,印度醫藥工業從近乎空白發展成為世界市場高質量、低成本的仿制藥領導者,滿足印度所有原料藥和幾乎所有制劑藥需求,成為世界市場仿制藥低價供應商,並有越來越多的藥企成為跨國大藥廠合同生產和合同定制合作夥伴。印度制藥工業經過了三個發展階段:
1947--01970年,進口藥和外資藥企壟斷:1947年印度獨立,藥品主要通過跨國藥企進口,進口藥占80-90%市場份額,99%是專利藥,全球藥價最高,制藥行業基本為空白;1960s仍然是進口依賴,前10大藥企有8家是跨國藥企分支機構,跨國藥企市場份額超過70%。
1970--02000年,印度本土制藥企業快速在國內和國際市場發展:1970s印度政府為實現藥品自給,廢除藥品化合物專利、控制藥品價格、提高關稅限制進口、限制外企持股比例,跨國藥企紛紛退出印度,政府培養本土制藥企業,降低進入壁壘;1980s印度制藥企業開始出口大宗原料藥,至今仍在多種大宗原料藥上占據壟斷地位;1990s印度制藥企業在寬松的專利制度下,逐步形成成熟的仿制藥反工藝技術,制劑藥本土制藥企業能夠全部自給,原料藥也幾乎能夠自給,向國際市場大規模出口仿制藥API,配合仿制藥企業制劑藥註冊,並將業務垂直一體化,縱向延伸至仿制藥制劑出口。
2000年--現在,成為世界市場高質量、低成本的仿制藥領導者和合同研發、合同生產領跑者:在國際市場進行了一系列跨國並購,從在國際區域市場設立營銷中心到收購當地營銷企業再到收購當地仿制藥企業,從而將低成本產品快速滲透至國際區域市場,有多家企業仿制藥挑戰專利成功,獲得美國180天市場專營權,同時印度多家藥企成為世界市場合同研發和合同生產的領導者;在國內市場,印度政府控制價格,國內藥品銷售金額規模較小,2005年印度跨國藥企市場份額低於20%,2005年印度政府修改專利法,重新啟用藥品化合物專利,在知識產權保護上和國際市場接軌,從而為跨國藥企重新占據印度市場提供了政策環境。

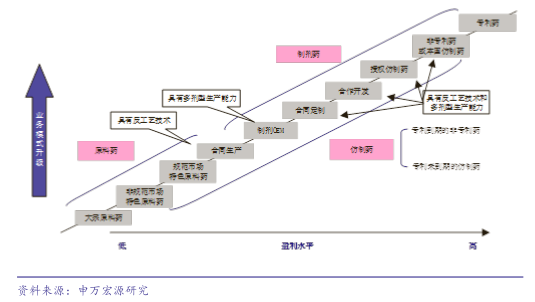
制藥企業產業發展路徑就是向價值鏈的高端不斷升級,印度制藥企業在國際上的發展路徑為中國藥企提供了可借鑒的戰略意義,雖然印度制藥企業發展策略上有確實的缺陷,比如低價搶奪市場,擾亂了市場自身也沒有獲得持續高速增長,但是我們看到印度制藥行業在國際市場地位不斷提升,制藥企業給投資者也帶來了階段性超額回報。
西普拉—印度仿制藥領先企業
西普拉(Cipla)是印度知名藥企,成立於1935年,創始人為阿蔔杜拉·哈米爾德博士,公司主營業務為原料藥、中間體和制劑的生產與出口,公司制劑以仿制藥為主,制劑出口業務涵蓋了全球170余國家和地區,至2016年,公司共擁有近1500種不同的制劑品種,涵蓋了心血管疾病,關節炎,糖尿病,肥胖,抑郁等領域。
近年來公司規模逐步壯大,2016財務年度公司實現收入1389億盧比,同比增長21%,2011-2016年收入CAGR為17%;實現利潤151億盧比,同比增長28%,2011-2016年利潤CAGR9%。其中,制劑出口業務收入占比達57%,是公司的主要收入來源之一,印度本國制劑業務收入占比為38%。
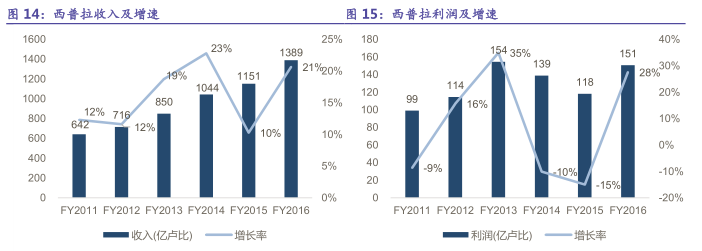

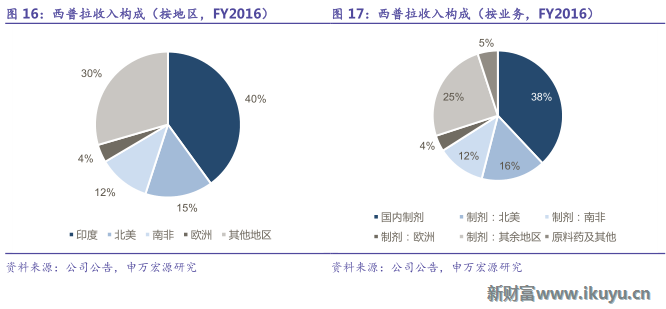
2016財務年度公司在印度本國銷售收入520億盧比,收入占比40%,同比增長6%,2011-2016年CAGR13%;除此之外,北美地區是西普拉出口最大地區之一,2016財務年度公司在北美地區銷售收入207億盧比,受InvaGen和Exelan並表影響,同比增長68%,2011-2016年CAGR32%,截止到2016年財務年度,公司已經向FDA申請了165個ANDA,85個品種獲批。

公司註重研發投入,2016財務年度公司研發費用79億盧比,占公司收入的6.5%,

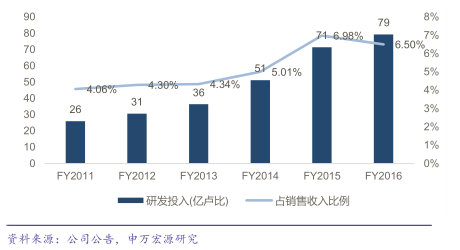
他山之石,可以攻玉
回顧西普拉的發展歷程,國際化是優秀仿制藥企業面臨的必由之路,而印度寬松的專利政策及公司前瞻的海外布局是成功的關鍵。對標國內,我國藥品出口正在經歷:從無到有、從原料藥到制劑、從非規範到規範市場的發展進化過程,目前處在初期加速拓展階段,未來潛力巨大。建議重點關註:恒瑞醫藥:國內化藥龍頭企業,研發實力雄厚,多個創新藥及仿制藥在海內外進行不同階段臨床試驗,2016年恒瑞醫藥制劑出口收入4.32億元,未來將有更多品種獲批,海外管線不斷豐富,成為公司業績增長的重要增量。
(完)
股市有風險,投資需謹慎。本文僅供受眾參考,不代表任何投資建議,任何參考本文所作的投資決策皆為受眾自行獨立作出,造成的經濟、財務或其他風險均由受眾自擔。

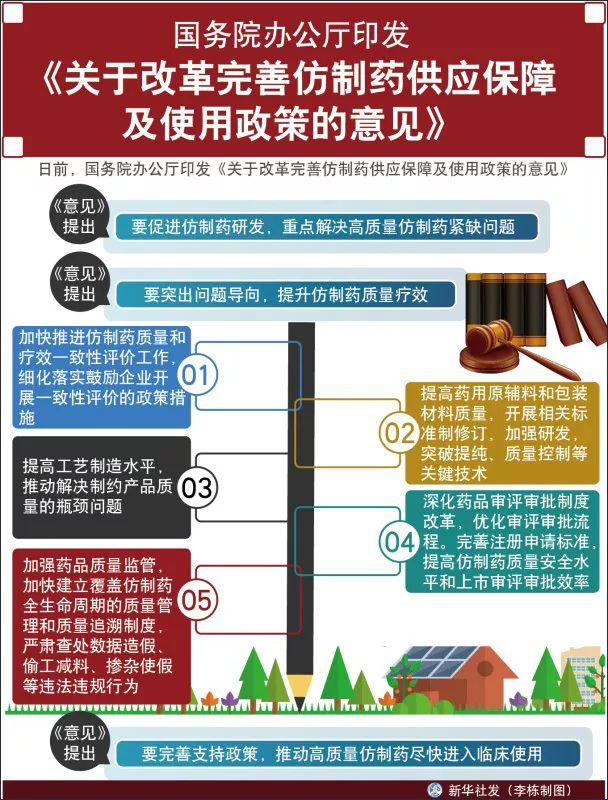
國辦:完善支持政策,推動高質量仿制藥盡快進入臨床使用
日前,國務院辦公廳印發《關於改革完善仿制藥供應保障及使用政策的意見》。
《意見》指出,改革完善仿制藥供應保障及使用政策,事關人民群眾用藥安全,事關醫藥行業健康發展。要圍繞仿制藥行業面臨的突出問題,促進仿制藥研發,提升質量療效,完善支持政策,推動醫藥產業供給側結構性改革,提高藥品供應保障能力,降低全社會藥品費用負擔,保障廣大人民群眾用藥需求,加快我國由制藥大國向制藥強國跨越,推進健康中國建設。
《意見》提出,要促進仿制藥研發,重點解決高質量仿制藥緊缺問題。一是定期制定並公布鼓勵仿制的藥品目錄,引導企業研發、註冊和生產。二是加強仿制藥技術攻關,將鼓勵仿制藥品的關鍵共性技術研究列入國家相關科技計劃。三是研究完善與我國經濟社會發展水平和產業發展階段相適應的藥品知識產權保護制度,充分平衡藥品專利權人與社會公眾的利益。
《意見》提出,要突出問題導向,提升仿制藥質量療效。一是加快推進仿制藥質量和療效一致性評價工作,細化落實鼓勵企業開展一致性評價的政策措施。二是提高藥用原輔料和包裝材料質量,開展相關標準制修訂,加強研發,突破提純、質量控制等關鍵技術。三是提高工藝制造水平,推動解決制約產品質量的瓶頸問題。四是深化藥品審評審批制度改革,優化審評審批流程。完善註冊申請標準,提高仿制藥質量安全水平和上市審評審批效率。五是加強藥品質量監管,加快建立覆蓋仿制藥全生命周期的質量管理和質量追溯制度,嚴肅查處數據造假、偷工減料、摻雜使假等違法違規行為。
《意見》提出,要完善支持政策,推動高質量仿制藥盡快進入臨床使用。一是及時將仿制藥納入采購目錄,啟動采購程序,促進質量和療效一致的仿制藥與原研藥平等競爭。二是將質量和療效一致的仿制藥納入與原研藥可相互替代藥品目錄,在說明書、標簽中予以標註,強化藥師在藥品調配中的作用。三是加快制定醫保藥品支付標準,與原研藥質量和療效一致的仿制藥和原研藥按相同標準支付,促進仿制藥替代使用。四是明確藥品專利實施強制許可路徑,依法分類實施藥品專利強制許可,鼓勵專利權人自願許可,必要時國家實施強制許可。五是落實稅收優惠政策和價格政策,鼓勵地方結合實際出臺支持仿制藥轉型升級的政策措施。六是加快藥品研發、註冊、上市銷售的國際化步伐,支持企業開展國際產能合作,建立跨境研發合作平臺,推動仿制藥產業國際化。
仿制藥進口替代加速,優質藥品納入醫保
在中美貿易戰打得火熱時,中國仿制藥替代進口原研的行動也開始提速。
4月3日,國務院辦公廳正式下發《關於改革完善仿制藥供應保障及使用政策的意見》(下稱《意見》,對於通過一致性評價的仿制藥品種,明確了後續的落地優惠政策,在采購、醫保、稅收、宣傳等多方面給予高質量仿制藥以支持。
“這是個很好的政策。不管是仿制藥還是創新藥,能夠進入醫保報銷目錄、最終進入醫院才是核心。要真正做到進口替代,就是在醫保報銷上只報銷通過一致性評價的仿制藥,這就和美國商業保險的政策相同了(即不報銷原研藥)。”南京應諾醫藥董事長鄭維義在接受第一財經采訪時表示,“既然你的仿制藥已經和原研藥一致了,只有從醫保報銷制度上規定了,中國的仿制藥才能真正做好,進口替代才能成為現實。無疑,這個政策給仿制藥企業吃了一個定心丸。”
不過,鄭維義也表示,這對於一些中小企業來講,生存壓力更大,將會進行一輪的大淘汰和整合,未來中國藥企的集中度更高。
事實上,仿制藥在中國的戰略地位做實的過程,也將是中國仿制藥企業淘汰、整合、集中的過程,是中國由仿制藥大國轉向仿制藥強國的必經之路。
仿制藥將是主流產品
發展仿制藥,是我國建立醫藥工業體系的基礎。仿制藥價格較低,有利於控制治療成本、提高患者用藥保障水平,在各國均受到高度重視。在發達國家,仿制藥是控制藥費的重要方法,是在鼓勵創新的同時維持醫藥衛生行業可持續發展的戰略性考量。
就美國而言,它作為全球最大的醫藥市場,2016年處方藥市場有89%為仿制藥,在過去10年里,仿制藥為美國節約了約1.68萬億美元的醫療費用。
“因此,中國更需要仿制藥,必須加快制定仿制藥供應保障及使用政策,加快推進仿制藥大國向仿制藥強國的轉變,樹立公眾對仿制藥的信心,才能有效提高我國用藥可及性,有效減緩醫藥費用快速增長的速度,實現全民健康。”北京大學藥學院教授史錄文表示。
由於歷史因素,中國仿制藥在藥效上一直和原研藥有差距,使得中國醫藥市場存在著大量安全無效、低價的劣質藥,與此同時,還有專利過期的進口藥霸占著市場,消耗了大量的中國醫保費用,而這些都需要中國推進提高仿制藥質量、用以全面替代進口藥的工作。
“過去在招標采購中,因為一品雙規(醫院在中標的藥品目錄中采購同一通用名稱藥品的品種,註射劑型和口服劑型各不得超過 2 種),導致國外的產品價格比中國產品高;其次,最低價招標,導致國內產品只能打價格戰,這日趨加重了劣藥驅逐良藥現象,導致中國仿制藥在質量上因為成本的問題,一直提高不上去。”一位藥品專家表示,“另外,原研藥招標分組不同,在一品雙規體系下同時保持較高價格和較高份額,給醫保體系帶來較大支付壓力。事實上,仿制藥仍將是未來我國醫藥市場的主流產品。”
中國是仿制藥大國,近17萬個藥品批文中95%以上都是仿制藥,4376家企業中有近60%為仿制藥企業。仿制藥的發展為中國缺醫少藥的歷史劃上了句號,也正因此,仿制藥的未來必須展開,才能完成“健康中國”之夢。
“仿制藥一致性評價已經展開,但是必須給它一個身份,需要文件上給予支持和落實,否則仿制藥企業的信心不足,在醫保、使用環節都需要保障。” 鄭維義表示。
仿制藥替代原研加速
中國仿制藥存在低水平重複建設、高端供給不足的問題,臨床需求高的藥品在專利過期後仍無仿制的現象屢有發生。如何有效引導高質量有序仿制、優化醫藥產業結構,成為了此次《意見》重要著力點。
在臨床研究機構緊缺的當前,《意見》要求進一步釋放仿制藥一致性評價資源,制定鼓勵仿制的藥品目錄,以需求為導向,鼓勵仿制臨床必需、療效確切、供應短缺的藥品,鼓勵仿制重大傳染病防治和罕見病治療所需藥品、處置突發公共衛生事件所需藥品、兒童使用藥品以及專利到期前一年尚沒有提出註冊申請的藥品。
在使用環節,更是立足替代原研。《意見》要求藥品采購按藥品通用名,仿制藥與原研平等競爭,在臨床上加強監督療效與原研一致的仿制藥使用情況,對於不合理用藥的處方醫生將進行約談。在醫保上,發揮基本醫療保險的激勵作用。加快制定醫保藥品支付標準,與原研藥質量和療效一致的仿制藥、原研藥按相同標準支付。
“構建以臨床需求為導向的仿制藥研發機制,充分利用市場調節作用,發揮企業、醫療機構、科研機構、高等院校等相關方自主參與研究的積極性,是快速提升我國仿制藥質量水平的重要保障,調動市場積極性。制定完善的支持政策,保障仿制藥合理使用,是仿制藥大國向強國轉變的重要體現,也是根本目標。”史錄文表示。
民生證券醫藥領域研究員肖漢山對第一財經表示:“衛健部門制定鼓勵使用仿制藥的政策和激勵措施,除特殊情形外,處方上不得出現商品名,在按規定向艾滋病、結核病患者提供藥物時,優先采購使用仿制藥;與原研藥質量和療效一致的仿制藥、原研藥按相同標準支付,及時將符合條件的藥品納入基本醫保目錄,不得按商品名或生產廠家進行限定。由此看來,進口藥品的仿制藥替代將持續加速。”
醫藥領域並購整合
這一劑定心丸,對於3000多家仿制藥企來講,既是機遇,也是挑戰。
機遇是,在《意見》中規定了仿制藥研發的保障機制和使用環節的保障機制,使得仿制藥的生存環境更優。挑戰便是,將有更多的小企業將無法生存,醫藥產業的淘汰還將持續一陣。
“這個政策出臺後,大大鼓勵了仿制藥一致性評價,讓仿制藥企業的利益有了保障,企業有了回報,才能更進一步解決創新問題,科研也會加強。”鄭維義表示,一致性評價的投入很高,一個品種需要500萬元~1000萬元的資金成本,而且環保成本的增加,使得一些小企業的壓力更大。因此,醫藥產業的下一輪並購將繼續,醫藥領域將出現更集中、大而強、研發能力更強的趨勢。
事實上,這場醫藥產業大魚吃小魚的遊戲早已開始。國務院2015年8月發布《關於改革藥品醫療器械審評審批制度的意見》之後,中國藥企的數量已經消失了689家。從原國家食藥監總局發布《2017年度食品藥品監管統計年報》中可以發現,截至2017年11月底,全國共有原料藥和制劑生產企業4376家。而這個數字在2015年尚為5065家。
“其實這兩年,醫藥領域的並購一直在持續,標的已經被篩過很多遍了,優質標的越來越少。” 北京鼎臣醫藥咨詢負責人史立臣對第一財經表示。
早在2015年藥審改革的啟動,多種措施都在收緊中小仿制藥企業的生存空間。2016年連續出臺了《藥品、醫療器械產品註冊收費標準》調整了藥品註冊收費標準,從過去的20萬元批號換證提高到62.4萬元。從批號終身制到五年一換證。這一道行政命令,讓那些手中握著上百張藥品批號的企業,極為慎重地開始了篩選。
隨後,原國家食藥監總局又緊接著發布了《關於開展藥物臨床試驗數據自查核查工作的公告(2015年第117號)》,以及《關於開展仿制藥質量和療效一致性評價的意見》,使得過去存在臨床數據造假的藥品自行選擇了退出,而想繼續生產的藥企必須進行藥品一致性評價,直到仿制藥與原研等效。
根據投中(CVSource)數據庫統計,2014年,國內醫藥行業宣布並購案例343起,已公布金額累計130.29億美元。其中已完成的並購案例為119起,已公布並購規模累計達到72.14億美元。2016年並購宣布交易案例647起,交易規模223.99億美元,與2015年相比,數量下降了11.73%,交易額下降了12.99%。
截至2017年10月25日,醫藥生物類上市公司發生並購事件223起,總涉及金額約490億元。並購市場雖然較2015年有所回落,但是大體上在各個指標上都超越了之前的幾年,因此並購市場處於穩步平衡發展的過程中。
“做一個品種的一致性評價,所需費用至少500萬~1000萬元,這對75%的銷售額在5000萬元以下的企業來講,是無法承擔的。因此,在啟動仿制藥一致性評價之前,一個藥品批號交易上千萬元,啟動之後,十幾萬元就可以買到一個批號。”史立臣表示。
當批號變得不值錢時,那些不足5000萬元銷售額的企業,要麽把自己賣出去,要麽轉型。
“近年來,產業資本在醫藥領域的活躍度持續提升,包括恒瑞醫藥、泰格醫藥在內的多家公司相繼參與產業投資基金的募集合作。產業資本參與並購也愈發普遍,複星醫藥、藥明康德等公司最具代表性。我們認為,未來產業資本整合在醫藥行業將越來越常見。”肖漢山對第一財經表示。
一致性評價優勢
肖漢山認為,在一致性評價進度領先的企業將具有卡位優勢,有機會利用自身產品率先上市後的機會獨享政策紅利;另一方面,一致性評價成本較高,單個品種的BE(生物等效性)支出在500萬元以上,小型仿制藥企業面臨巨大資金壓力。隨著一致性評價的進行,仿制藥質量的提高,落後藥企將被淘汰,行業集中度提升,強者恒強格局盡顯。
“在政策的推動下,醫療行業的並購整合是大趨勢,藥企設立基金參與並購實際上是在搶奪市場份額。2016年GMP改造大限一到,釋放出很多優質的標的。但前兩年大量的並購案例出現,使得優質的醫藥標的越來越少。”史立臣表示。
“隨著優質標的逐步完成並購,並購的熱度有所降低。具體到並購標的的類型上,目前公司更看重標的的研發能力、渠道等,交易目的以行業整合和多元化戰略發展為主。”肖漢山表示,舉例來說,2017年的幾例並購案,包括複星醫藥並購印度Gland Pharma、上海醫藥收購康德樂中國、輔仁藥業收購開藥集團、東城藥業並購南京安迪科等,均以彌補自身產業空白、擴展渠道為主要目標。對於大型仿制藥企業來說,其研發實力、資金實力相比小企業具有顯著優勢,且後者的業務與大企業呈現同質化特點,因此仿制藥領域的並購在數量上來說是大概率下行。
此外,肖漢山認為,醫藥並購基金活躍度持續提升,上市公司更是參與的重點。上市公司憑借資金優勢,自行或聯合其他機構設立產業基金,成為產業資本並購整合的主體。
據統計,截至2017年上半年,上市公司參與設立的醫療產業基金近100家,資金規模上千億元。參與的上市公司包括恒瑞醫藥、複星醫藥、麗珠集團、片仔癀、雲南白藥、樂普醫療等知名企業。並購基金的投資通常以上下遊的補全、自身業務的拓展、創新品種的並購、渠道的擴容為主,如藥明康德通過產業基金先後投資了天演藥業、百濟神州、基石藥業、巨諾(Juno)等公司。
“具有高需求、稀缺性的治療性藥品將受到重視,也將成為以後仿制藥企業的主攻方向。”肖漢山表示,“衛健委提供的數據顯示,2012~2016年全球共有631個專利到期原研藥,由於供求信息不對稱,其中的大多數在我國並無企業提出仿制註冊申請。當然,目前我國仿制藥企業正在迎頭趕上,多個優質企業已展開高品質仿制藥的申請。以目前納入優先審評程序的藥品為例,截至2017年底,CDE共將25批423件申請納入優先審評程序,其中非創新藥達到232件,占比55%。”
惡臭擾民15年 納稅大戶泰瑞制藥被“回頭看”盯上
“請到劉主任房間開會,下午就要看點。”1日下午14時46分,國家環境保護督察辦公室工作人員通過微信給記者發來通知。
就在3個多小時前,中央第二環境保護督察組對寧夏回族自治區開展“回頭看”工作動員會剛剛結束。
在這個動員會上,中央第二環境保護督察組組長吳新雄要求,“回頭看”要堅持問題導向,敢於動真碰硬;對第一輪中央環境保護督察反饋問題緊盯不放,一盯到底;重點盯住督察整改不力,甚至“表面整改”“假裝整改”“敷衍整改”等生態環保領域形式主義、官僚主義問題”;重點督辦人民群眾身邊生態環境問題立行立改情況。
動員會後,督察組設立的專門值班電話(0951-5986000)立即開通,並通過媒體對外發布。讓督察組感到有些吃驚的是,舉報電話公布不到1小時,督察組就接到5個舉報電話,其中有4個是反映寧夏泰瑞制藥股份有限公司(下稱“泰瑞制藥”)惡臭問題的。
“今天就看這一家了。”國家環境保護督察辦公室副主任劉長根對記者們說。
劉長根的面前鋪著一張寧夏回族自治區的地圖,他指著永寧縣的位置說:“這里離我們住的地方不遠,時間上比較合適。關鍵是這里的泰瑞制藥這些年群眾投訴不斷,生態環境部這些年不斷收到舉報。群眾反映每周一到周五,泰瑞制藥每天都有排放惡臭。”
6月1日下午,國家環境保護督察辦公室副主任劉長根帶隊檢查泰瑞制藥。攝影/章軻
2016年11月16日,中央第八環境保護督察組向寧夏回族自治區反饋督察情況時指出,2013年至2015年,全區9個縣(市、區)在招商引資過程中引進醫藥、農藥、染料中間體等項目近60個,加之部分企業環保設施運行和日常監管不到位,成為汙染治理難點和群眾投訴熱點。
2017年第一季度全國“12369”環保舉報辦理情況顯示,寧夏泰瑞制藥股份有限公司淩晨1至3點排放惡臭氣味。
寧夏回族自治區環保廳2017年的一份《關於建議責令永寧縣制藥及生物發酵企業停產整治的函》介紹,從2003年以來,永寧縣3家制藥及生物發酵企業惡臭擾民環境問題成為群眾投訴的焦點、社會各界關切的熱點、環境治理的難點。這3家企業中,泰瑞制藥名列其中。
按照要求,泰瑞制藥需要建大氣超低超凈項目及異味治理提煉車間、發酵車間,同時建設汙水異味設施三期精準升級擴建工程,以及汙水零排放工程。
簡短的5分鐘碰頭後,劉長根帶著幾名督察組人員和3名記者分乘兩輛小汽車直奔泰瑞制藥。
半個多小時後,車輛駛入望遠大道,鄰近泰瑞制藥時,一股藥廠生物發酵的異味便鉆進車內。“劉主任,你聞到了吧?”第一財經記者問劉長根。“聞到了。就是藥廠的味。”他回答說。
顯然,泰瑞制藥異味治理的效果並沒有達到,周邊群眾的投訴並非“空穴來風”。
進入廠區,惡臭依然刺鼻。在菌渣處理提取車間和汙水處理站,劉長根仔細查看運行情況。“汙水處理池上的蓋子是環保督查後安裝的,但密閉性並不好。”劉長根說。
在菌渣出運點,原來沒有任何密閉裝置。出渣時惡臭最為劇烈。後來按環保要求建了密閉房。劉長根等督查人員來到這里時,卷簾門緊閉。門打開後,惡臭撲鼻而來。房間的地上還零星散落著菌渣。這個密閉房實際上就是一個簡易的鐵皮房,不僅密閉性差,還沒有任何抽風設備。“這是典型的表面整改、假裝整改。”劉長根說。
在泰瑞制藥的在線監測運行間,督查人員發現,測量排放物的量程被人為放大了近十倍。“就像用磅秤稱戒指,能準嗎?”一位督查人員說。在自備電廠中控室,劉長根還發現了二氧化硫瞬間超標,氮氧化物超標以及粉塵監控不正常等問題。
離開泰瑞企業時,劉長根對這家企業的負責人說,企業要想在這個地方生存和發展,臭味的問題必須徹底解決,讓老百姓滿意。“臭味僅僅達標還不算,老百姓說了算。”
據第一財經記者了解,6月1日,督察組共接到群眾舉報電話32個,其中,13個是反映泰瑞制藥惡臭汙染問題的。有居民反映“泰瑞制藥晚上不定時偷偷排放惡臭,大熱天晚上不敢開窗。經常投訴,解決無果。前年環保督察組來了之後情況好些,但督察組走了之後,又不行了。”“泰瑞制藥排放臭味氣體,附近建設許多學校,影響當地居民生活和學習。地方政府多年治理無效果。強烈要求搬遷。”
今年4月公布的《寧夏2017年度納稅貢獻突出企業名單》,泰瑞制藥榜上有名。
6月1日下午,國家環境保護督察辦公室副主任劉長根帶隊檢查泰瑞制藥。攝影/章軻
上市一年天聖制藥遭遇人事黑天鵝,踩雷的機構自認倒黴?
上市剛滿一年的天聖制藥(002872.SZ)近期高管層接連爆雷。
自今年4月3日開始的近兩個月左右時間,天聖制藥已有4名高管相繼“出事”。先是董事長劉群和總經理李洪相繼被有關部門留置,再是副總經理李忠和副總經理王永紅因涉嫌犯罪被公安機關刑事拘留。
對於背後的原因,業內大多猜測與重慶醫藥購銷腐敗案有關。對於兩者是否有關聯,以及高管“出事”對上市公司業務帶來的影響,天聖制藥董秘辦人士回應稱,一切以公告為準。
不過,對於在解禁前夕踩雷的機構投資者而言,天聖制藥的“黑天鵝”事件帶來的影響不可小覷。有業內人士認為,影響大小,後續需要看上市公司是否能持續正常運營,其中產品是否具有技術含量較為重要。而天聖制藥的近兩年的研發費用占比不到2%,且7成左右收入來自於醫藥流通板塊。
遭遇人事黑天鵝
6月6日,天聖制藥公告稱,王永紅於今年5月31日因涉嫌犯罪已被公安機關刑事拘留,不能履行公司副總經理職務,該公司董事會已收到王永紅提交的書面辭職報告,辭職後,王永紅不再擔任公司任何職務。
這是近兩個月以來,天聖制藥第4名高管“出事”。今年4月3日午間,天聖制藥爆出第一個雷,稱董事長劉群被相關機構要求協助調查。此後又公告稱,被有關機構口頭告知董事長於3月24日被有關機關留置。截至今年一季度末,劉群持有天聖制藥6864.12萬股,持股比例為32.38%,為實際控制人。
蹊蹺的是,天聖制藥是在4月1日獲知了劉群被協助調查之事,但4月3日午間才對外公布,而就在4月3日早間,該公司因擬披露重大事項,股票臨時停牌,並在當日午間公布正在籌劃重大資產重組事項。這停牌時間是巧合嗎,還是對股價的有意“保護”?
此後的5月份,天聖制藥集中爆雷。先是5月5日被告知該公司總經理被有關部門留置,再是幾日後的5月10日副總經理李忠因涉嫌犯罪被公安機關刑事拘留,目前李忠也已申請辭去了副總經理職務。
4名核心高管接連“出事”到底源自何因?位列天聖制藥2016年度前五大客戶的重慶市涪陵區中心醫院和重慶市南川區人民醫院院長相繼被開除黨籍和公職,成為市場的關註點。
根據招股說明書,重慶市微創外科研究所(下稱“微創外科”)持有天聖制藥子公司重慶天聖藥業有限公司的股東,而微創外科是重慶市涪陵中心醫院附屬的研究機構,所以涪陵中心醫院為上市公司的關聯方。2016年度,天聖制藥對前述兩家醫院的銷售金額分別為1.48億元、1.13億元;另據天聖制藥2017年度報告,上市公司與重慶市涪陵中心醫院產生關聯交易1.59億元。
對此,第一財經記者分別致電上述醫院辦公室,詢問院長違紀是否與天聖制藥有關,但獲得的回應均是“不清楚”。天聖制藥對此則回應稱,以公告為準。
與高管接連“出事”形成對應的是,該公司籌劃了2個月的重大資產重組原預計在6月1日前披露預案並複牌,但由於重組方案仍需進一步協商確定,該公司申請延期複牌。天聖制藥擬以發行股份的方式收購四川省玉鑫藥業有限公司全部股權,不涉及配套募集資金,最終交易方式以經公司董事會審議並公告的重組方案為準。
根據天聖制藥此前的公告,該公司董事長此前帶隊參與了此次重組。對此,深圳證券交易所提出問詢,董事長和總經理被有關部門留置會否會影響重組。
“本次資產重組事項正在公司代董事長的主持下繼續推進,如有進一步進展或者發生對公司資產重組事項產生重大影響的情形,公司將依法及時履行信息披露義務。”天聖制藥回應稱。
機構股東解禁前夕踩雷
天聖制藥是於去年5月19日上市,在上市之前引入了15家外部股東,其中多為股權投資機構。然而就在解禁期前夕,天聖制藥爆出人事黑天鵝,隨後又停牌。若後續複牌後股價下跌,一眾機構也將面臨收益縮水甚至可能被悶殺的風險。
2010年8月份,天聖制藥(原天聖股份)引入外部股東,北京力鼎財富成長投資管理中心(有限合夥)、廣州力鼎凱得創業投資有限合夥企業(有限合夥)(下稱“力鼎凱得”,380.8萬股)、上海賓州投資有限公司、天津和光成長股權投資基金合夥企業(有限合夥)、中山市多美之家商貿有限公司(下稱“中山多美”)以6.88元/股的價格參與增資。
2012年6月份,天聖制藥進行第三次增資,蘇州貝塔股權投資合夥企業(有限合夥)、重慶德同創業投資中心(有限合夥)(下稱“德同創業”,300萬股)、成都德同銀科創業投資合夥企業(有限合夥)、上海力鼎明陽創業投資管理中心(有限合夥)、 天津和光遠見股權投資基金合夥企業(有限合夥)(下稱“和光遠見”,35萬股) 5家機構投資者,以及上述的中山多美,以8.5元/股進行了增資。
2014年8月份,在第四次股份變動,天聖制藥新引進宿遷華元興盛投資合夥企業(有限合夥)、宿遷人合安康投資合夥企業(有限合夥)、昆明龍興投資中心(有限合夥)、新疆盛世誠金股權投資合夥企業(有限合夥)、重慶泰豪渝晟股權投資基金中心(有限合夥) 5 家機構投資者以及雷春風、濮翔2名自然人投資者以外,上述的德同創業(150萬股)也參與增發,認購價格為每股10元。
以此來看,上述機構投資者的持股成本價在6.8元/股~10元/股之間。天聖制藥停牌前的股價為31.05元/股。這意味著目前上述機構投資者的浮盈在3倍~4.5倍區間。以持股最多的德同創業來看,按照300萬股和150萬股分別對應的成本價來算,目前合計浮盈9922.5萬元;以成本最低時持股較多機構投資者力鼎凱得來看,目前也浮盈9203.94萬元;上述機構投資者中持股最少的和光遠見,目前僅浮盈789.25萬元。
今年5月21日起,上述15家外部股東的持股解禁,但因天聖制藥股票停牌而無法流通。若之後天聖制藥因為受到高管事宜的影響而股價受挫,那麽上述股權投資機構的收益預期將會打折扣,受影響嚴重的話,有些機構投資者可能會因此而虧損。面對這樣的情況,機構投資者又該如何處理?
在上述參與增資機構投資者中,一位不願透露姓名的機構高管告訴第一財經記者,目前也在對天聖制藥高管之事進行了解,具體情況不方便透露。至於投資收益可能縮水,他表示,所投公司出事了,有可能收益會受影響,但市場上也有很多投資“打水漂”的情況,在目前上市比較難得情況下,企業上市對於投資機構而言就算成功。
一家專註於醫藥領域投資的股權投資機構董事長則表示,股權投資機構遇到這種黑天鵝現象且股票又被鎖住了,只能自認倒黴,難有解決的辦法,“如果上市公司後續有人能夠頂起來維持正常運營,或者公司的產品具有技術含量,不需要用回扣也能賣的出去,那麽影響會小一些”。
研發費用是衡量一家公司產品是否具有技術含量的一大指標。根據天聖制藥2017年度報告,2016年、2017年,該公司投入研發費用分別為3511.84萬元、3385.79萬元,占營收比例僅為1.68%、1.50%。上述機構董事長認為,這樣的研發投入比例不高。
天聖制藥主要從事醫藥制造與醫藥流通業務,其中近兩年來,醫藥流通業務收入占公司總營收的70%左右,醫藥制造業務貢獻的收入占比不到3成。
一財研選|後發優勢顯著,國內生物仿制藥望迎來爆發式發展!
券商研報浩如煙海,投資線索眼花繚亂,第一財經推出《一財研選》產品,挖掘研報精華,每期梳理5條投資線索,便於您短時間內獲取有價值的信息。專業團隊每周日至每周四晚8點準時“上新”,助您投資順利!
2018年6月10日目錄
►後發優勢顯著,國內生物仿制藥望迎來爆發式發展(國金證券)
►三維度看醫藥行情並未結束,逢低加配白馬龍頭(興業證券)
►庫存持續保持低位運行,鋼鐵板塊反攻行情或已啟動(方正證券)
►我國正步入“光”加工時代,激光產業投資機會顯現(新時代證券)
►高鎳電池放量趨勢形成,“三劍客”業績增速望加大(國泰君安)
1.後發優勢顯著,國內生物仿制藥望迎來爆發式發展(國金證券)
目前全球生物藥市場超過2000億美金並且仍舊保持高速增長。國金證券認為從臨床角度,生物藥均為治療的一線用藥,主要集中於腫瘤、自身免疫性疾病和代謝相關疾病,重磅炸彈集中;抗體類藥物作為生物藥的一個分支,全球銷售額從2011年的不到500億美金增加到2017年的1060億美金,7年的複合增長率為11.50%。

根據IMS統計,銷售額約合800億美金的生物藥將在2020年前陸陸續續到期。生物原研藥的專利到期為生物類似藥上市奠定了市場空間。


據了解,較先行的歐盟已於2004年出臺類似藥的註冊路徑,美國於2010年出臺生物制品價格競爭與創新法案(BPCIA),中國在2015年出臺生物類似藥的註冊征求意見稿,國金證券預計未來將很快出臺生物類似藥註冊的正式稿。全球生物類似藥註冊路徑的明確降低了生物類似藥研發註冊過程中面臨的不確定性,縮短研發時間。未來,隨著生物原研藥專利到期和國際各國生物類似藥臨床註冊路徑的清晰,生物類似藥出現蓬勃發展,預計到2020年全球銷售額有望超過90億美金。

中國市場由於審批和醫保準入等歷史問題,生物藥的臨床需求遠未滿足。另一方面,國內後發優勢依然明顯:生物類似藥研發可以省去臨床II期,效率大大提高,同時依賴後發優勢大大提高臨床成功率;可以采用更高表達量的細胞株和生產工藝降低成本。隨著近期醫保談判目錄的落地,解決了生物藥上市之後的市場準入和醫保支付問題,國內生物藥奇點臨近,行業有望迎來爆發式發展。

國金證券認為,國內生物類似藥即將迎來蓬勃發展,參照品種布局和臨床進展,重點推薦複星醫藥(600196.SH)、中國生物制藥(1177.HK)、麗珠集團(000513.SZ)、三生制藥(1530.HK)、沃森生物(300142.SZ)。

2.三維度看醫藥行情並未結束,逢低加配白馬龍頭(興業證券)
剛剛過去的5月,醫藥板塊表現跌宕起伏,很多龍頭股、基金重倉股、前期強勢品種在月末都出現了迅速的下跌,引發投資者關註。

興業證券認為,5月最後一周的行情只能稱之為“小春寒”,並不影響整個二、三季度醫藥的表現,2018年仍是醫藥大年。從三個維度看,醫藥行情都不會就此結束。

首先,從投資者追求確定性的角度而言,醫藥行情並沒有結束。2018年,宏觀經濟的不確定性明顯增加。在這種背景下,消費類板塊成為為數不多的資金“避風港”,在沒有出現重大邏輯變化的情況下,始終會是機構投資者“抱團取暖”的理想板塊。這其中,醫藥作為一個以內需為主,終端需求平穩增長,增量供給釋放周期長的行業,其成長的穩定性又是最強的。可以說,在宏觀經濟政策沒有重大變化、其他大體量消費類板塊2017年累計漲幅較大的背景下,很難找出性價比明顯高於醫藥的板塊。

其次,從估值業績匹配性角度而言,醫藥行情並沒有結束。從2016年開始,醫藥板塊上市公司的利潤表現就開始拐頭向上,溫和複蘇。到2018年一季度,歸屬上市公司股東的凈利潤同比增長35.16%,是近年來的最高峰。從估值來看,從2017年初至今,醫藥板塊漲幅約為18%,而上市公司的凈利潤增速在過去五個季度中卻提升了超過30%。因此,雖然部分公司的估值處在歷史較高水平,但板塊整體的估值中樞卻是不升反降,從醫藥板塊整體來看,板塊還遠遠稱不上估值“泡沫化”。

最後,從機構持倉的角度來看,醫藥行情也沒有結束。雖然2018年一季度投資者已經“不約而同”地選擇了加倉醫藥,但與歷史高峰相比依然差距甚遠,考慮到近期醫藥基金的申購和發行,配置比例仍有提升空間。
興業證券認為,在這波2014年以來最大幅度的醫藥牛市行情中,白馬龍頭是大家不可不配的底倉品種。包括創新產業鏈的恒瑞醫藥(600276.SH)、樂普醫療(300003.SZ)、泰格醫藥(300347.SZ);消費升級相關的美年健康(002044.SZ)、愛爾眼科(300015.SZ)、片仔癀(600436.SH)、益豐藥房(603939.SH);轉型升級的華海藥業(600521.SZ)等。
3.庫存持續保持低位運行,鋼鐵板塊反攻行情或已啟動(方正證券)
數據顯示,今年5月份鋼材平均每周去化速度在70萬噸左右,在傳統需求淡季,再結合略有上升的鋼材產量數據來看,這樣的表現充分說明鋼鐵需求淡季不淡。最新的鋼材總庫存為1543.84萬噸,已低於去年同期的水平。並且庫存結構持續優化,鋼廠庫存繼續保持在低位,偏高的螺紋和線材社會庫存在快速去化。

方正證券指出,鋼鐵庫存持續快速下降疊加環保限產,基本面向好支撐鋼價走強。6月初環保督查組已赴多個省市開展為期一個月的環保督查,很多地方已經采取了部分限產措施;地條鋼清查小組目前已經分赴各地進行中(工)頻爐清除;環保限產疊加中(工)頻爐將對鋼鐵供給造成一定擾動,6月份行業供給增加將受到限制。需求韌性較強疊加供給受限,月份庫存仍有望同比較快下滑,有望出現較明顯的低庫存狀況,基本面向好對鋼價形成較強支撐。

根據Mysteel全國鋼廠成本調研報告,5月全國主要高爐企業噸鋼利潤環比4月繼續改善,仍維持在高位。根據模型測算,5月主要鋼材品種噸鋼毛利均維持在1000元/噸左右;預計6月鋼價有望繼續走強,鋼廠高利潤有望繼續維持。在鋼價走強和高利潤維持的背景下,預計上市公司二季度業績環比一季度提高10%~20%。

方正證券指出,前期在政府去杠桿、信用債危機發酵和貿易摩擦的影響下,市場宏觀預期和風險偏好帶來周期板塊估值大幅壓縮。近期宏觀經濟預期有所修複,結合目前高發電量和鋼材庫存持續快速去化,表明經濟韌性仍很強;央行擴大MLF擔保品範圍開始扭轉前期因信用債負面帶來的市場對應流動性過度悲觀的預期。宏觀經濟預期的好轉有望助力板塊估值的修複,鋼鐵股有望迎來一波超跌反彈行情。

2月底高位至今,鋼鐵板塊已累計下跌超過15%,目前鋼鐵板塊平均動態市盈率只有9.1倍,板塊配置性價比較高。方正證券強烈推薦低估值高彈性的優質鋼企華菱鋼鐵(000932.SZ)、南鋼股份(600282.SH)、新鋼股份(600782.SH),建議關註安陽鋼鐵(600569.SH)、韶鋼松山(000717.SZ)。
4.我國正步入“光”加工時代,激光產業投資機會顯現(新時代證券)
新時代證券指出,激光被譽為“最快的刀、最準的尺、最亮的光”,媲美核能、計算機和半導體。激光加工以效率高、精密度高、不易受材料限制、具備柔性等優勢,逐步替代傳統加工制造、如焊接、切割、鉆孔等,深化新領域應用、如3D打印、脆性材料異形加工、汽車輕量化、激光熔覆、表面處理等。近年來中國激光加工技術快速發展,帶動新興領域和傳統制造工藝革新,中國繼歐美日韓之後正闊步進入“光”加工時代。

根據LMR統計,2017年全球激光器銷售增長18.2%,其中工業用激光器增長26.1%;工業用光纖激光器因其結構緊湊、穩定可靠、光電轉換效率高等銷售增長33.7%,占比提升至47%、較2013年提升13個百分點。Technavio預計,2021年亞太地區光纖激光器需求占全球比重提升至46%,主要因亞太地區汽車、消費電子、半導體、以及機械加工制造業需求旺盛。

新時代證券指出,2016年初以來,十三五先進制造技術領域創新專項、增材制造產業發展行動、高端智能再制造行動計劃等均提出對激光及其加工設備支持、力度明顯加大。根據中國激光產業發展報告,得益於下遊新興需求多點開花、傳統領域需求不斷增長,2017年中國激光設備市場規模達到495億元、同比增長28%,2010~2017年複合增速26%。根據2018年中國激光產業發展報告,預計2018年中國激光設備市場規模將超過600億元、同比增長超過20%。

根據中國激光產業發展報告,2016年國產中功光纖率激光器市占率58.5%、較2013年提升超過40個百分點,中功率光纖激光切割設備銷售量增長166%。國產化率提升促進激光器價格下降,終端用戶和激光設備企業實現雙贏,加速激光設備應用。新時代證券認為,未來隨著中高功率激光器國產化提升,激光器價格將持續下降,國內企業有望憑借性價比優勢開闊國內市場、競逐海外市場。參考國際巨頭德國通快集團和美國IPG成長路徑,新時代證券建議兩條路徑尋找激光產業投資機會:基於機床集成優勢的激光設備系統集成商,掌握核心工藝的光纖或半導體激光器龍頭。

新時代證券推薦關註亞威股份(002559.SZ),建議關註華工科技(000988.SZ)、大族激光(002008.SZ)、銳科激光(300747.SZ)。

5.高鎳電池放量趨勢形成,“三劍客”業績增速望加大(國泰君安)
2018年是高鎳電池放量元年,電池廠大規模的向高鎳的切換,高鎳正極材料和高鎳電解液的需求爆量期來臨,高鎳正極和電解液享受更高議價。

國泰君安指出,采用811高鎳正極,電池廠成本下降6~8%,正極材料毛利率翻倍,且可以提高汽車續航里程,是一種多贏局面。2018年將是811高鎳電池量產元年,將率先在技術成熟度更高的圓柱電池上量產,國內比克、億緯、遠東福斯特、力神、澳洋順昌等均已量產。未來幾年811高鎳正極材料需求大爆發,供給端技術成熟企業較少,因此長期將保持供不應求的局面,同時高鎳電池的應用也將帶動高鎳配套電解液的需求。

高鎳電池已開始應用於整車中。韓國電池廠商LG與SK在2017年宣布將於今年量產NCM811動力電池,今年3月國外第一輛搭載NCM811電池的電動汽車現代Kona EV已經面市,年內投入市場。國內車企江淮、大眾江淮、通用五菱、雲度均使用811動力電池,進度大超市場預期。

國泰君安認為,正極銷售處於高位,高鎳正極將提供業績彈性。鈷價處於高位,正極售價也處於高位,以杉杉為例,2017年公司正極平均售價僅為20萬元,2018年受鋰鈷價格均在高位影響,公司產品單價將會得到明顯提升,毛利率不變的情況下,公司盈利將同比明顯增加。當前高鎳811的產品價格為27萬元/噸,622產品價格為25萬元/噸,523價位為23萬元/噸,市場上短期能實現有效供應的高鎳企業較少,全年需求預計1.5萬噸~2萬噸,供給偏緊的態勢下,高鎳享有較強的議價和盈利能力。杉杉股份具備7200萬噸高鎳正極產能,當升科技具備4000噸高鎳正極產能。

國泰君安同時認為,高鎳電解液也享有更高的議價。新宙邦是高鎳電解液龍頭,公司在高鎳電解液上技術積累雄厚,擁有多項國際專利技術,且公司通過收購巴斯夫電解液工廠及專利技術,進一步增厚自己高鎳技術積累,目前811電解液還出口到海外。另外,2017~2018年公司資本開支快速增長,新建5座工廠均在未來3年內投產,極大的增加了公司業績彈性,預計未來三年業績將大幅增長。

重點公司方面,國泰君安推薦杉杉股份(600884.SH)、當升科技(300073.SZ)和新宙邦(300037.SZ)。

潤都制藥被爆“踩雷” 到底冤不冤
雖然國家藥監局已經公布,除華海藥業外,其他6家國內纈沙坦原料藥生產企業NDMA雜質檢出值都低於限值或者未檢出,但是依然擋不住大火燃燒到其中一個纈沙坦原料藥企業——珠海潤都制藥。
8月2日,臺灣生達制藥公司發出通知稱,珠海潤都制藥(下稱‘潤都制藥’)供應的纈沙坦原料藥檢出極微量N-亞硝基二甲胺(NDMA)成分。這一通知使得珠海潤都上市公司(潤都股份002923)股票在8月6日跌停。
“纈沙坦”事件並沒有隨著國家藥監局對所有纈沙坦原料藥生產企業風險排查的結束而結束。
2018年7月6日,華海藥業發布公告稱,其在用於出口的纈沙坦原料藥中檢出微量N-亞硝基二甲胺(NDMA)雜質,具有致癌性。
為了排除風險,7月6日以來,國家藥監局組織專家開展風險評估,經研判,根據毒理學數據推算NDMA的每日最大攝入限量為0.1μg,相當於EMA暫定參考限定值0.3ppm(按每日服用320mg纈沙坦計算)。根據上述限定值,國家藥監局對所有國內在產的7家纈沙坦原料藥生產企業(含華海藥業)進行風險排查,除華海藥業纈沙坦原料藥NDMA雜質超出限值外,其他國內纈沙坦原料藥生產企業NDMA雜質檢出值低於限值或者未檢出。
但這依然擋不住大火燒到潤都制藥。
“我們銷售給生達制藥公司的纈沙坦的生產工藝於2014年獲得臺灣地區食藥署嚴格審核並得到批準,在臺灣地區食藥署審核期間並未要求我公司控制該雜質。截至2018年8月2日,我公司銷售給生達制藥公司的纈沙坦原料藥,均經生達制藥公司檢測合格後才用於纈沙坦制劑產品的生產。”8月10日晚,珠海潤都制藥質量負責人蘇軍對第一財經表示。
由纈沙坦原料藥生產的藥品主要用於治療高血壓。最新的官方數據預估,當前中國高血壓患病人數已達2.7億。
據了解,纈沙坦在生產過程,有三個可能產生NDMA的環節:1、疊氮化鈉中含有亞硝酸鈉,向二甲胺溶液中加入疊氮化鈉,反應液檢測出NDMA;2、纈氨酸甲酯制備過程,使用濃硫酸、甲醇、氨水,在一定條件下有產生二甲胺的可能;3、纈沙坦中間體烴化物中在二氯甲烷中加入亞硝酸鈉,能檢測出NDMA。
目前,歐盟等多國藥品監管機構認為,NDMA屬於2A類致癌物(即動物實驗證據充分,人體可能致癌但證據有限),日常生活中都可能接觸這種物質(例如腌制食品)。纈沙坦中含有極微量的NDMA雜質,經調查,該雜質系纈沙坦生產工藝產生的固有雜質,含量極微,且就業內采用的相同生產工藝而言,具有共性。
“我公司在國內銷售的纈沙坦原料藥,經檢驗NDMA含量均低於0.3ppm(歐盟暫定標準為<0.3ppm)。結合我公司自檢結果評判,我公司產品符合EMA暫定參考限定值。”蘇軍表示。
據蘇軍介紹,潤都制藥已對公司生產的373批次纈沙坦原料藥進行了自檢 [采用檢驗方法的定量限為0.08ppm(定量限:可以準確檢驗出的NDMA最低量),該數值遠低於EMA暫定參考限定值0.3ppm],同時委托第三方檢驗機構抽取了連續3個批次送檢,結果均低於限定值0.3ppm。
臺灣地區之前尚無NDMA標準。8月2日,臺灣地區監管部門新發布NDMA雜質限度值——不得過0.1ppm,這一數值遠低於歐盟標準的限度要求。
與此同時,海外某媒體發布題為《韓國降壓藥檢出致癌物,原料來自珠海廠商》的報道,也讓潤都制藥震驚。
“我公司從未在韓國註冊Valsartan(纈沙坦)原料藥,亦未向韓國市場銷售過纈沙坦原料藥。公司按合同要求僅向韓國市場銷售纈沙坦原料藥的原材料(即原料粗品),韓國企業必須經過後續的生產工序制成纈沙坦原料藥上市銷售。”蘇軍表示,8月6日韓國發布了纈沙坦中NDMA限度標準也為0.3ppm。
“我們自2016年初至今向生達制藥公司供應的纈沙坦原料藥金額為31.2125萬美元(折合人民幣約205萬元)。目前公司需要根據生達制藥公司對其制劑召回的情形作出有效的判斷,進而與生達制藥公司協商解決方案後,才能評估因生達制藥公司對其產品召回將會給公司帶來的影響。公司正積極與生達制藥公司進行協商,以將影響降到最低。”蘇軍表示。
2017年度,潤都制藥公司纈沙坦原料藥銷售金額為4602.46萬元,占2017年度公司銷售收入5.90%;2018年上半年,潤都制藥公司的纈沙坦原料藥銷售金額為2866.28萬元,約占2018年上半年銷售收入6.01%。目前潤都制藥公司暫無纈沙坦制劑銷售。
此內容為第一財經原創。未經第一財經授權,不得以任何方式加以使用,包括轉載、摘編、複制或建立鏡像。第一財經將追究侵權者的法律責任。 如需獲得授權請聯系第一財經版權部:021-22002972或021-22002335;[email protected]
責編:胥會雲
證監會處罰5宗操縱市場案 高勇操縱精華制藥遭罰沒18億
2018年8月10日,證監會召開例行發布會,以下為主要內容:
1、證監會處罰5宗操縱市場案 包括民間配資等“加杠桿”操縱
證監會新聞發言人高莉10日表示,證監會對5宗操縱市場案件做出行政處罰。其中,證監會依法對高勇操縱市場案作出處罰,沒收高勇違法所得897,387,345.82元,並處以897,387,345.82元罰款;依法對王仕宏、陳傑操縱市場案作出處罰,對王仕宏、陳傑分別處以100萬元罰款;依法對褚連江操縱市場案作出處罰,沒收褚連江違法所得425,428.65元,並處以2,127,143.25元罰款;依法對謝一峰操縱市場案作出處罰,沒收謝一峰違法所得6,543,998.61元,並處以19,631,995.83元罰款;依法對郁紅高操縱市場案作出處罰,責令郁紅高依法處理非法持有的證券,沒收其違法所得5,842,003.07元,並處以17,526,009.21元罰款。
上述案件中,高勇控制利用2個集合資金信托計劃子賬戶及14個自然人賬戶,通過信托計劃等方式放大資金杠桿,集中資金優勢,以連續封漲停、連續交易等手段對“精華制藥”實施了操縱行為;王仕宏作為時任國泰君安證券股份有限公司(以下簡稱國泰君安)場外市場部總經理助理、做市業務部負責人,與陳傑串謀,通過做市商專用證券賬戶及陳傑實際控制賬戶,利用國泰君安做市商地位,在做市交易過程中采用在收盤前10分鐘以主動低價申報賣出成交等方式打壓或鎖定股價,對“福昕軟件”等14只股票實施了操縱行為;褚連江控制利用相關賬戶組,通過盤中虛假申報買入後反向賣出等方式對“百川股份”等8只股票實施了操縱行為;謝一峰控制利用公司賬戶、私募基金賬戶及其他個人賬戶組成的賬戶組,采用盤中拉擡、虛假申報及大額封漲停等多種方式對“紅宇新材”等7只股票實施了操縱行為;郁紅高控制使用40個賬戶,利用資金優勢連續買賣、在實際控制賬戶間交易及虛假申報等方式,對“經緯紡機”等4只股票實施了操縱行為。
上述案件顯露出市場操縱行為的一些新特點,其中較為顯著的是,有些違法行為人為獲取更大的資金優勢,通過民間配資、資管計劃、私募基金等途徑“加杠桿”實施操縱,所動用的資金量往往非常巨大,在個股盤中交易快進快出,極易引發市場異常波動,釋放虛假的市場信號,嚴重幹擾投資者正常的交易決策,損害投資者合法權益。同時,操縱行為通常會積聚個股風險,而這些操縱行為所借助的資金杠桿渠道往往存在結構化設計和強行平倉機制,在大盤下跌或者個股風險釋放過程中可能會觸發股價下跌的連鎖反饋,發生價格踩踏,進一步加劇市場風險,其危害不容小覷,必須嚴厲打擊。我會將繼續加強監管執法力度,從嚴打擊各類操縱市場行為,依法嚴懲違法行為人,維護公平公正的市場秩序,保護投資者合法權益。
2、證監會:目前在進一步研究證券公司股權管理規定
證監會新聞發言人高莉10日在發布會上通報了上半年規章規範性文件制定情況。高莉表示,資本市場是法制保障、規則導向的市場。完善資本市場的制度規則,夯實資本市場制度基礎,是確保資本市場長期、穩定、健康、繁榮發展的根本大計。2018年上半年以來,證監會緊緊圍繞服務實體經濟、防控金融風險、深化金融改革三項任務,根據《證券法》《證券投資基金法》《期貨交易管理條例》等法律、行政法規的規定要求,緊密結合實際,大力加強資本市場基礎制度建設,共制定出臺規章9件、規範性文件23件,並有5件規章履行公開征求意見程序。
一是適應資本市場改革開放需要,制定修改相關制度規則。包括,制定《存托憑證發行與交易管理辦法(試行)》,修改《首次公開發行股票並上市管理辦法》《首次公開發行股票並在創業板上市管理辦法》《證券發行與承銷管理辦法》《外商投資證券公司管理辦法》等四部規章,制定試點紅籌企業發行上市、持續監管、保薦機構盡職調查、會計處理、存托協議指引以及證券基金經營機構使用香港機構證券投資咨詢服務暫行規定等十二部規範性文件。研究起草《外商投資期貨公司管理辦法》《證券公司和證券投資基金管理公司境外設立、收購、參股經營機構管理辦法》,擬有序擴大證券業對外開放。
二是積極完善上市公司制度,會同國資委、財政部聯合發布《上市公司國有股權監督管理辦法》,制定《上市公司創業投資基金股東減持股份的特別規定》,修訂《公開發行證券的公司信息披露編報規則第19號——財務信息的更正及相關披露》《公開發行證券的公司信息披露編報規則第14號——非標準審計意見及其涉及事項的處理》,研究起草《上市公司治理準則》《關於修改<關於改革完善並嚴格實施上市公司退市制度的若幹意見>的決定》,針對上市公司監管領域出現的新問題、新情況作出規範。
三是健全多層次資本市場制度體系,制定《區域性股權市場信息報送指引(試行)》,充分發揮區域性股權市場信息報送的“監管工具箱”作用;制定《證券期貨業場外市場交易系統接口》金融行業系列標準,實現對證券公司櫃臺市場業務的統一監管。
四是進一步強化證券期貨行業機構監管,集中發力證券期貨經營機構行業制度建設,密集出臺了《證券期貨經營機構及其工作人員廉潔從業規定》《關於加強證券公司在投資銀行類業務中聘請第三方等廉潔從業風險防控的意見》《證券公司投資銀行類業務內部控制指引》《關於進一步規範貨幣市場基金互聯網銷售、贖回相關服務的指導意見》等,夯實新階段證券期貨行業規範發展的基礎。研究起草《證券公司股權管理規定》,擬全面系統整合證券公司股權管理相關要求,規範證券公司股東行為。
五是加強資本市場誠信制度建設,修訂《證券期貨市場誠信監督管理辦法》,制定《關於在一定期限內適當限制特定嚴重失信人乘坐火車和民用航空器實施細則》,進一步豐富證券期貨市場誠信監管的“工具箱”,為誠信監管裝上“牙齒”。
此外,證監會還修改完善了《行政許可實施程序規定》,重點解決各證券中介服務機構暫不受理、中止審核政策不統一的問題。制定《養老目標證券投資基金指引(試行)》《證券期貨投資者教育基地監管指引》等,對相關領域進行引導、規範。
這些規章、規範性文件的制定出臺,完善了資本市場制度規則,健全了市場運行的體制機制,對於從根本上優化市場體系結構,規範市場主體行為,提高市場質量,具有重大意義。
(以上內容根據現場速記整理而成)
責編:張瑜
Next Page


