- 股票掌故
- 香港股票資訊
- 神州股票資訊
- 台股資訊
- 博客好文
- 文庫舊文
- 香港股票資訊
- 第一財經
- 微信公眾號
- Webb哥點將錄
- 港股專區
- 股海挪亞方舟
- 動漫遊戲音樂
- 好歌
- 動漫綜合
- RealBlog
- 測試
- 強國
- 潮流潮物 [Fashion board]
- 龍鳳大茶樓
- 文章保管庫
- 財經人物
- 智慧
- 世界之大,無奇不有
- 創業
- 股壇維基研發區
- 英文
- 財經書籍
- 期權期指輪天地
- 郊遊遠足
- 站務
- 飲食
- 國際經濟
- 上市公司新聞
- 美股專區
- 書藉及文章分享區
- 娛樂廣場
- 波馬風雲
- 政治民生區
- 財經專業機構
- 識飲色食
- 即市討論區
- 股票專業討論區
- 全球政治經濟社會區
- 建築
- I.T.
- 馬後砲膠區之圖表
- 打工仔
- 蘋果專欄
- 雨傘革命
- Louis 先生投資時事分享區
- 地產
Random Tags
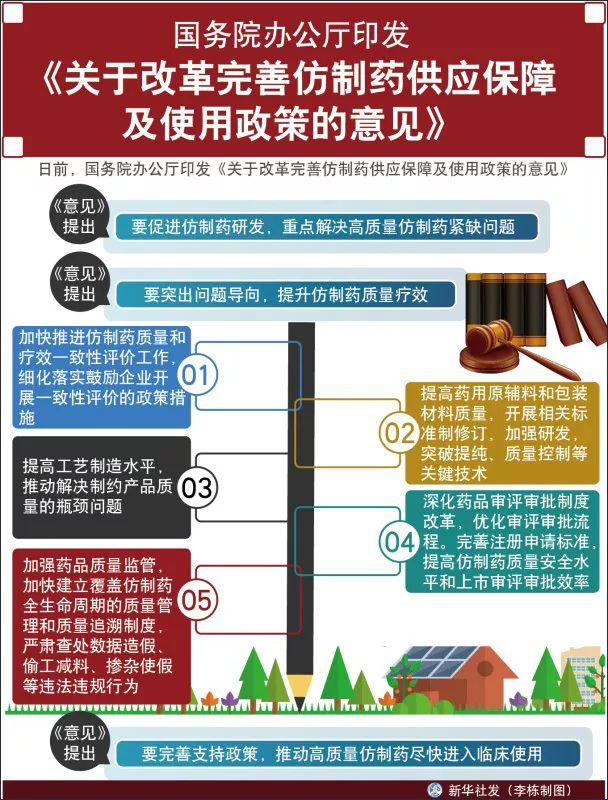
仿制藥進口替代加速,優質藥品納入醫保
在中美貿易戰打得火熱時,中國仿制藥替代進口原研的行動也開始提速。
4月3日,國務院辦公廳正式下發《關於改革完善仿制藥供應保障及使用政策的意見》(下稱《意見》,對於通過一致性評價的仿制藥品種,明確了後續的落地優惠政策,在采購、醫保、稅收、宣傳等多方面給予高質量仿制藥以支持。
“這是個很好的政策。不管是仿制藥還是創新藥,能夠進入醫保報銷目錄、最終進入醫院才是核心。要真正做到進口替代,就是在醫保報銷上只報銷通過一致性評價的仿制藥,這就和美國商業保險的政策相同了(即不報銷原研藥)。”南京應諾醫藥董事長鄭維義在接受第一財經采訪時表示,“既然你的仿制藥已經和原研藥一致了,只有從醫保報銷制度上規定了,中國的仿制藥才能真正做好,進口替代才能成為現實。無疑,這個政策給仿制藥企業吃了一個定心丸。”
不過,鄭維義也表示,這對於一些中小企業來講,生存壓力更大,將會進行一輪的大淘汰和整合,未來中國藥企的集中度更高。
事實上,仿制藥在中國的戰略地位做實的過程,也將是中國仿制藥企業淘汰、整合、集中的過程,是中國由仿制藥大國轉向仿制藥強國的必經之路。
仿制藥將是主流產品
發展仿制藥,是我國建立醫藥工業體系的基礎。仿制藥價格較低,有利於控制治療成本、提高患者用藥保障水平,在各國均受到高度重視。在發達國家,仿制藥是控制藥費的重要方法,是在鼓勵創新的同時維持醫藥衛生行業可持續發展的戰略性考量。
就美國而言,它作為全球最大的醫藥市場,2016年處方藥市場有89%為仿制藥,在過去10年里,仿制藥為美國節約了約1.68萬億美元的醫療費用。
“因此,中國更需要仿制藥,必須加快制定仿制藥供應保障及使用政策,加快推進仿制藥大國向仿制藥強國的轉變,樹立公眾對仿制藥的信心,才能有效提高我國用藥可及性,有效減緩醫藥費用快速增長的速度,實現全民健康。”北京大學藥學院教授史錄文表示。
由於歷史因素,中國仿制藥在藥效上一直和原研藥有差距,使得中國醫藥市場存在著大量安全無效、低價的劣質藥,與此同時,還有專利過期的進口藥霸占著市場,消耗了大量的中國醫保費用,而這些都需要中國推進提高仿制藥質量、用以全面替代進口藥的工作。
“過去在招標采購中,因為一品雙規(醫院在中標的藥品目錄中采購同一通用名稱藥品的品種,註射劑型和口服劑型各不得超過 2 種),導致國外的產品價格比中國產品高;其次,最低價招標,導致國內產品只能打價格戰,這日趨加重了劣藥驅逐良藥現象,導致中國仿制藥在質量上因為成本的問題,一直提高不上去。”一位藥品專家表示,“另外,原研藥招標分組不同,在一品雙規體系下同時保持較高價格和較高份額,給醫保體系帶來較大支付壓力。事實上,仿制藥仍將是未來我國醫藥市場的主流產品。”
中國是仿制藥大國,近17萬個藥品批文中95%以上都是仿制藥,4376家企業中有近60%為仿制藥企業。仿制藥的發展為中國缺醫少藥的歷史劃上了句號,也正因此,仿制藥的未來必須展開,才能完成“健康中國”之夢。
“仿制藥一致性評價已經展開,但是必須給它一個身份,需要文件上給予支持和落實,否則仿制藥企業的信心不足,在醫保、使用環節都需要保障。” 鄭維義表示。
仿制藥替代原研加速
中國仿制藥存在低水平重複建設、高端供給不足的問題,臨床需求高的藥品在專利過期後仍無仿制的現象屢有發生。如何有效引導高質量有序仿制、優化醫藥產業結構,成為了此次《意見》重要著力點。
在臨床研究機構緊缺的當前,《意見》要求進一步釋放仿制藥一致性評價資源,制定鼓勵仿制的藥品目錄,以需求為導向,鼓勵仿制臨床必需、療效確切、供應短缺的藥品,鼓勵仿制重大傳染病防治和罕見病治療所需藥品、處置突發公共衛生事件所需藥品、兒童使用藥品以及專利到期前一年尚沒有提出註冊申請的藥品。
在使用環節,更是立足替代原研。《意見》要求藥品采購按藥品通用名,仿制藥與原研平等競爭,在臨床上加強監督療效與原研一致的仿制藥使用情況,對於不合理用藥的處方醫生將進行約談。在醫保上,發揮基本醫療保險的激勵作用。加快制定醫保藥品支付標準,與原研藥質量和療效一致的仿制藥、原研藥按相同標準支付。
“構建以臨床需求為導向的仿制藥研發機制,充分利用市場調節作用,發揮企業、醫療機構、科研機構、高等院校等相關方自主參與研究的積極性,是快速提升我國仿制藥質量水平的重要保障,調動市場積極性。制定完善的支持政策,保障仿制藥合理使用,是仿制藥大國向強國轉變的重要體現,也是根本目標。”史錄文表示。
民生證券醫藥領域研究員肖漢山對第一財經表示:“衛健部門制定鼓勵使用仿制藥的政策和激勵措施,除特殊情形外,處方上不得出現商品名,在按規定向艾滋病、結核病患者提供藥物時,優先采購使用仿制藥;與原研藥質量和療效一致的仿制藥、原研藥按相同標準支付,及時將符合條件的藥品納入基本醫保目錄,不得按商品名或生產廠家進行限定。由此看來,進口藥品的仿制藥替代將持續加速。”
醫藥領域並購整合
這一劑定心丸,對於3000多家仿制藥企來講,既是機遇,也是挑戰。
機遇是,在《意見》中規定了仿制藥研發的保障機制和使用環節的保障機制,使得仿制藥的生存環境更優。挑戰便是,將有更多的小企業將無法生存,醫藥產業的淘汰還將持續一陣。
“這個政策出臺後,大大鼓勵了仿制藥一致性評價,讓仿制藥企業的利益有了保障,企業有了回報,才能更進一步解決創新問題,科研也會加強。”鄭維義表示,一致性評價的投入很高,一個品種需要500萬元~1000萬元的資金成本,而且環保成本的增加,使得一些小企業的壓力更大。因此,醫藥產業的下一輪並購將繼續,醫藥領域將出現更集中、大而強、研發能力更強的趨勢。
事實上,這場醫藥產業大魚吃小魚的遊戲早已開始。國務院2015年8月發布《關於改革藥品醫療器械審評審批制度的意見》之後,中國藥企的數量已經消失了689家。從原國家食藥監總局發布《2017年度食品藥品監管統計年報》中可以發現,截至2017年11月底,全國共有原料藥和制劑生產企業4376家。而這個數字在2015年尚為5065家。
“其實這兩年,醫藥領域的並購一直在持續,標的已經被篩過很多遍了,優質標的越來越少。” 北京鼎臣醫藥咨詢負責人史立臣對第一財經表示。
早在2015年藥審改革的啟動,多種措施都在收緊中小仿制藥企業的生存空間。2016年連續出臺了《藥品、醫療器械產品註冊收費標準》調整了藥品註冊收費標準,從過去的20萬元批號換證提高到62.4萬元。從批號終身制到五年一換證。這一道行政命令,讓那些手中握著上百張藥品批號的企業,極為慎重地開始了篩選。
隨後,原國家食藥監總局又緊接著發布了《關於開展藥物臨床試驗數據自查核查工作的公告(2015年第117號)》,以及《關於開展仿制藥質量和療效一致性評價的意見》,使得過去存在臨床數據造假的藥品自行選擇了退出,而想繼續生產的藥企必須進行藥品一致性評價,直到仿制藥與原研等效。
根據投中(CVSource)數據庫統計,2014年,國內醫藥行業宣布並購案例343起,已公布金額累計130.29億美元。其中已完成的並購案例為119起,已公布並購規模累計達到72.14億美元。2016年並購宣布交易案例647起,交易規模223.99億美元,與2015年相比,數量下降了11.73%,交易額下降了12.99%。
截至2017年10月25日,醫藥生物類上市公司發生並購事件223起,總涉及金額約490億元。並購市場雖然較2015年有所回落,但是大體上在各個指標上都超越了之前的幾年,因此並購市場處於穩步平衡發展的過程中。
“做一個品種的一致性評價,所需費用至少500萬~1000萬元,這對75%的銷售額在5000萬元以下的企業來講,是無法承擔的。因此,在啟動仿制藥一致性評價之前,一個藥品批號交易上千萬元,啟動之後,十幾萬元就可以買到一個批號。”史立臣表示。
當批號變得不值錢時,那些不足5000萬元銷售額的企業,要麽把自己賣出去,要麽轉型。
“近年來,產業資本在醫藥領域的活躍度持續提升,包括恒瑞醫藥、泰格醫藥在內的多家公司相繼參與產業投資基金的募集合作。產業資本參與並購也愈發普遍,複星醫藥、藥明康德等公司最具代表性。我們認為,未來產業資本整合在醫藥行業將越來越常見。”肖漢山對第一財經表示。
一致性評價優勢
肖漢山認為,在一致性評價進度領先的企業將具有卡位優勢,有機會利用自身產品率先上市後的機會獨享政策紅利;另一方面,一致性評價成本較高,單個品種的BE(生物等效性)支出在500萬元以上,小型仿制藥企業面臨巨大資金壓力。隨著一致性評價的進行,仿制藥質量的提高,落後藥企將被淘汰,行業集中度提升,強者恒強格局盡顯。
“在政策的推動下,醫療行業的並購整合是大趨勢,藥企設立基金參與並購實際上是在搶奪市場份額。2016年GMP改造大限一到,釋放出很多優質的標的。但前兩年大量的並購案例出現,使得優質的醫藥標的越來越少。”史立臣表示。
“隨著優質標的逐步完成並購,並購的熱度有所降低。具體到並購標的的類型上,目前公司更看重標的的研發能力、渠道等,交易目的以行業整合和多元化戰略發展為主。”肖漢山表示,舉例來說,2017年的幾例並購案,包括複星醫藥並購印度Gland Pharma、上海醫藥收購康德樂中國、輔仁藥業收購開藥集團、東城藥業並購南京安迪科等,均以彌補自身產業空白、擴展渠道為主要目標。對於大型仿制藥企業來說,其研發實力、資金實力相比小企業具有顯著優勢,且後者的業務與大企業呈現同質化特點,因此仿制藥領域的並購在數量上來說是大概率下行。
此外,肖漢山認為,醫藥並購基金活躍度持續提升,上市公司更是參與的重點。上市公司憑借資金優勢,自行或聯合其他機構設立產業基金,成為產業資本並購整合的主體。
據統計,截至2017年上半年,上市公司參與設立的醫療產業基金近100家,資金規模上千億元。參與的上市公司包括恒瑞醫藥、複星醫藥、麗珠集團、片仔癀、雲南白藥、樂普醫療等知名企業。並購基金的投資通常以上下遊的補全、自身業務的拓展、創新品種的並購、渠道的擴容為主,如藥明康德通過產業基金先後投資了天演藥業、百濟神州、基石藥業、巨諾(Juno)等公司。
“具有高需求、稀缺性的治療性藥品將受到重視,也將成為以後仿制藥企業的主攻方向。”肖漢山表示,“衛健委提供的數據顯示,2012~2016年全球共有631個專利到期原研藥,由於供求信息不對稱,其中的大多數在我國並無企業提出仿制註冊申請。當然,目前我國仿制藥企業正在迎頭趕上,多個優質企業已展開高品質仿制藥的申請。以目前納入優先審評程序的藥品為例,截至2017年底,CDE共將25批423件申請納入優先審評程序,其中非創新藥達到232件,占比55%。”
Next Page